题目内容
1.乙炔是有机合成工业的一种原料,实验室常用电石与水反应制取(1)为获得稳定的乙炔气流,常常采取的措施用饱和食盐水代替纯水
(2)制取的气体中因含H2S、PH3而具有难闻的气味,要除去杂质可以将气体通入足量的CuSO4(或NaOH溶液)溶液
(3)CaC2中C22-与O22+互为等电子体,则O22+的电子式为
 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体(4)下列各物质均与CaC2类似他们与水反应所得产物判断正确的是ABD
A、Mg2C与水反应生成CH4 B、SiCl4与水反应生成H4SiO4
C、Li2C2与水反应生成C2H4 D、Li3N与水反应生成NH3
(5)乙炔与HCN反应可以生成CH3CH2CN,分子中处于同一直线上的原子数目最多为3个
(6)若乙炔与HCl发生加成后的产物在氢氧化钠的水溶液中加热充分反应后的到的有机物结构简式是CH2(OH)CH2OH、CH3CHO
(已知:
(7)若某烃0.5mol与1molHCl充分反应后最多还能与3molCl2发生反应则该烃可能的结构简式是CH≡CCH3、HC≡C-CH2-C≡CH.
分析 (1)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(2)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,据此解答即可;
(3)C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式;氯化钠晶胞中配位数为6,每个阴离子周围距离最近且相等的阳离子数目为6,CaC2晶胞结构与氯化钠晶体相似,据此分析;
(4)根据物质的结构来分析;
(5)H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上;
(6)若乙炔与HCl发生加成后的产物可能为1,2-二氯乙烷和1,1-二氯乙烷,据此分析水解产物;
(7)气态烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol二氯代物中含有3molH原子,即1mol二氯代物含有6molH原子,其中2molH原子由加成反应提供,故1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,以此解答该题.
解答 解:(1)为了控制水与电石的反应速率并得到平稳气流,采取的措施是用饱和食盐水代替水,故答案为:用饱和食盐水代替纯水;
(2)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,可用硫酸铜溶液或氢氧化钠溶液洗气除去,故答案为:CuSO4(或NaOH溶液);
(3)等电子体结构和性质相似,C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式为 ;CaC2晶胞结构与氯化钠晶体相似,而
;CaC2晶胞结构与氯化钠晶体相似,而
氯化钠晶胞中配位数为6,每个阴离子周围距离最近且相等的阳离子数目为6,故在CaC2晶体中与钙离子距离最近的C22-数目为6,围成的空间构型为正八面体.
故答案为: ;6;正八面体;
;6;正八面体;
(4)A、Mg2C与水反应时,Mg2+结合水中的OH-生成Mg(OH)2,C4-结合H+生成CH4,故A正确;
B、SiCl4与水反应,Cl-生成了HCl,Si4+生成H4SiO4,故B正确;
C、Li2C2与水反应,Li+结合OH-生成LiOH,C22-结合H+生成C2H2,故C错误;
D、Li3N与水反应,Li+结合OH-生成LiOH,N3-结合H+生成生成NH3,故D正确.
故选ABD;
(5)H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上,所以该分子中位于同一直线上的原子为3个,
故答案为:3;
(6)若乙炔与HCl发生加成后的产物可能为1,2-二氯乙烷和1,1-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中水解为乙二醇:CH2(OH)CH2OH;1,1-二氯乙烷在氢氧化钠溶液中先水解为1,1-乙二醇,但2个-OH连在同一个碳上的结构不稳定,易发生脱水生成CH3CHO,故答案为:CH2(OH)CH2OH、CH3CHO;
(7)气态烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,生成0.5mol二氯代物,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol二氯代物中含有3molH原子,即1mol二氯代物含有6molH原子,其中2molH原子由加成反应提供,故1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,故可以为CH≡CCH3或HC≡C-CH2-C≡CH.故答案为:CH≡CCH3;HC≡C-CH2-C≡CH.
点评 本题考查有机物结构的推断、加成反应、取代反应,以及晶体的空间构型,题目难度不大,注意有机物的加成和取代反应特征.

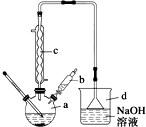 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
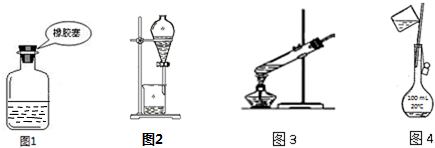
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |

(1)往含Pb2+的溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+,pH=9时,主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+.则脱铅的最合适pH 范围为B(填字母).
A.4~5B.6~7C.9~10D.11~12.
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.