题目内容
20.氢气可通过下列反应制得:CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g)△H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是( )| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
分析 为了提高氢气在平衡体系中所占的比例,可使平衡正向移动,结合外界条件对平衡移动的影响解答该题.
解答 解:A.因反应前后体积不变,则减小压强,平衡不移动,故A错误;
B.正反应放热,降低温度,平衡正向移动,故B正确;
C.加入催化剂,平衡不移动,故C错误;
D.减小CO的浓度,平衡逆向移动,氢气在平衡体系中所占的比例减小,故D错误.
故选B.
点评 本题考查学生化学平衡移动原理的应用方面的知识,为高频考点,侧重于学生的分析能力的考查,注意把握反应的特征以及影响平衡的因素,难度不大.

练习册系列答案
相关题目
10.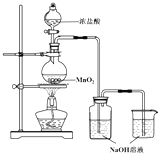 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟不恢复.
②此消毒液有效氯含量为1.4%(保留一位有效数字).获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟不恢复.
②此消毒液有效氯含量为1.4%(保留一位有效数字).获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
11.某温度下,体积一定的密闭容器中进行如下可逆的反应:X(g)+Y(g)?Z(g)+W(s)△H>0,下列叙述正确的是( )
| A. | 加入少量W,逆反应速率增大 | |
| B. | 因正反应吸热,所以升高温度正反应速率加快,逆反应速率减慢 | |
| C. | 当v(X)=v(Z)时,反应达到平衡 | |
| D. | 混合气体的密度不变时,反应达到平衡 |
15.下列关于化学反应速率的说法正确的是( )
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
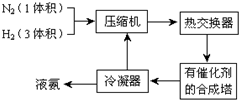
12.已知N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)△H=-92.22kJ•mol-1.下列对该反应的说法正确的是.
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |