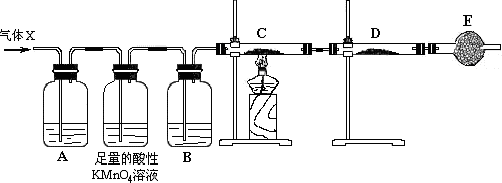
题目内容
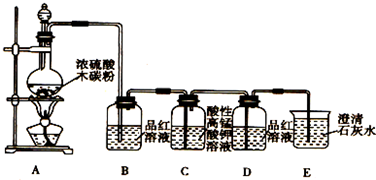
8.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程(如图1所示)制备ClO2: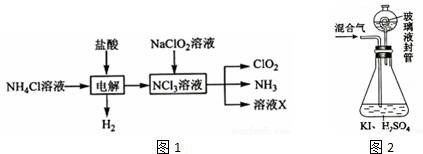
(1)电解时的阳极反应方程式为NH4++3Cl--6e-═NCl3+4H+.
(2)除去ClO2中的NH3可选用的试剂为是b(填标号).
a.水 b.浓硫酸 c.碱石灰 d.饱和食盐水
(3)用如图2装置可以测定混合气中ClO2的含量:
I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸;
II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III.将一定量的混合气体通入锥形瓶中吸收;
IV.将玻璃液封装置中的水倒入锥形瓶中;
V.用0.2000mol/L 硫代酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I-+S4O62-),指示剂显示终点时共用去20.00ml硫代酸钠溶液.在此过程中:
①玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出).
②V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色.
③测定混合气中ClO2的质量为0.05400g.
④用此方法测定混合气中ClO2的质量常常偏高,可能的原因是4I-+O2+4H+═2I2+2H2O(用离子方程式表示).
分析 (1)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3;
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①玻璃液封装置可防止有害气体逸出;
②淀粉遇碘单质变蓝;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),则生成的碘单质偏高,测定混合气中ClO2的质量就偏高,据此分析.
解答 解:(1)由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,则阳极反应方程式为NH4++3Cl--6e-═NCl3+4H+,
故答案为:NH4++3Cl--6e-═NCl3+4H+;
(2)a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.浓硫酸可以吸收氨气,且不影响ClO2,故b正确;
c.碱石灰不能吸收氨气,故c错误;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:b;
(3)①玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),故答案为:吸收残留的ClO2气体(避免碘的逸出);
②V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟内不变色;
③含有Na2S2O3物质的量为0.02 L×0.2mol/L=0.004 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.004mol
所以n(ClO2)=0.0008mol,所以m(ClO2)=0.008 mol×67.5g/mol=0.05400g,
故答案为:0.05400;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),则生成的碘单质偏高,测定混合气中ClO2的质量就偏高,又空气中的氧气会将KI氧化成碘单质导致碘单质偏高,离子方程式为:4I-+O2+4H+═2I2+2H2O,故答案为:4I-+O2+4H+═2I2+2H2O.
点评 本题考查较为综合,涉及物质含量的测定以及分离等知识,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.

 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O
制备过程中还可能的副反应有:
CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2CH2CH2CH3+H2O
主要实验步骤如下:
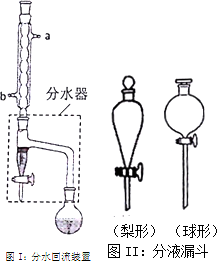
①在干燥的圆底烧瓶中加11.5mL正丁醇、7.2mL冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再如图Ⅰ装置安装好分水器、冷凝管.然后小火加热.
②将烧瓶中反应后的混后物冷却与分水器中的酯层合并,转入分液漏斗,
③依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥.
④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
(1)图I装置中冷水应从b(填a或b),管口通入,反应混合物冷凝回流,通过分水器下端旋塞分出的生成物是水,其目的是分离酯化反应生成的水,使平衡正向移动,提高反应产率.
(2)在步骤①④中都用到沸石防暴沸,下列关于沸石的说法正确的是AD.
A.实验室沸石也可用碎瓷片等代替
B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用
D.沸石为多孔性物质,可使液体平稳地沸腾
(3)在步骤③分液时,应选择图II装置中梨形分液漏斗,其原因是梨形分液漏斗靠近旋塞处比较细长,双液界面更清晰,分离更完全.
(4)在提纯粗产品的过程中,用碳酸钠溶液洗涤主要除去的杂质乙酸、硫酸、正丁醇.若改用氢氧化钠溶液是否可以不可以(填“可以”或“不可以”),其原因用氢氧化钠溶液会使乙酸正丁酯发生水解.
(5)步骤④的常压蒸馏,需收集126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂.
| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
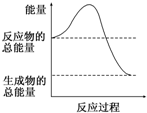
| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |
| A. | -441 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | +882 kJ/mol |

 .
.