题目内容
19.某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.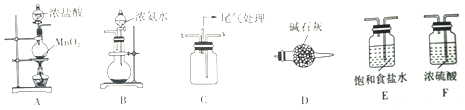
(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→E、F、C、D→B;为使NH3与Cl2更充分混合,Cl2应从C装置的x口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加.
(3)装置A中发生反应的离子方程式为MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.
(4)装置B中圆底烧瓶内的试剂为氢氧化钠固体、碱石灰或生石灰等(填名称).
(5)装置D的作用是吸收水蒸气,干燥氨气.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为3Cl2+8NH3═N2+6NH4Cl.
分析 A装置由二氧化锰和浓盐酸制备氯气,制得的氯气混有氯化氢气体和水蒸气,用E装置中的饱和食盐水吸收氯化氢,用F装置中的浓硫酸吸收水蒸气,由此得干燥纯净的氯气,
B装置由浓氨水制备氨气,由D装置中的碱石灰干燥,得干燥的氨气;
将纯净干燥的氯气和氨气在C装置中反应:3Cl2+8NH3═N2+6NH4Cl,为使气体充分混合,氯气从x进入,氨气从y进入,据此分析解答.
解答 解:(1)由分析,A装置制备氯气,E装置中的饱和食盐水吸收氯化氢,用F装置中的浓硫酸吸收水蒸气,B装置由制备氨气,由D装置中的碱石灰干燥,得干燥的氨气,再在C中反应,为使气体充分混合,氯气从x进入,氨气从y进入;
故答案为:E、F、C、D;x;
(2)装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加;
故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加;
(3)A中由二氧化锰和浓盐酸生成氯气,离子方程式为:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;
故答案为:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;
(4)氢氧化钠固体、碱石灰或生石灰等与浓氨水混合可制取氨气;
故答案为:氢氧化钠固体、碱石灰或生石灰等;
(5)装置D的作用是吸收水蒸气,干燥氨气;
故答案为:吸收水蒸气,干燥氨气;
(6)装置C内出现浓厚的白烟并在容器内壁凝结,为氯化铵,另一生成物是空气中的主要成分之一,则为氮气,故反应为:3Cl2+8NH3═N2+6NH4Cl;
故答案为:3Cl2+8NH3═N2+6NH4Cl.
点评 本题考查实验方案的设计,根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,熟悉氨气的制取、氯气的制取原理及物质的性质是解答本题的关键,题目难度中等.

| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反 应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能 与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低 肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
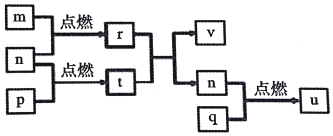 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
(1)2A(g)?2B(g)+C(g);
(2)A(g)?C(g)+D(g).当达到平衡时,测得c(A)=2.5mol•L-1,c(C)=2.0mol•L-1.则下列说法中正确的是( )
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
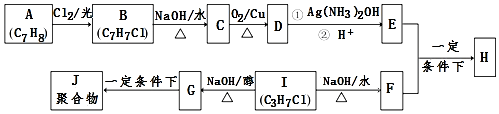
 .
. .
.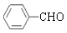 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: