题目内容
铁是人类利用最为广泛的金属之一,工业炼铁一般用一氧化碳作还原剂.
(1)已知Fe2O3在高炉中有下列反应:Fe2O3+CO
2FeO+CO2.反应形成的Fe2O3和FeO固体混合物中,元素铁和氧的质量比m(Fe):m(O)不可能是 .
a.7:3 b.21:8 c.14:5 d.7:2
(2)若m(Fe):m(O)=3:1,则Fe2O3与FeO的物质的量之比为 ,Fe2O3被CO还原的物质的量分数为 .
(3)3.04g Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,生成的CO2气体通入过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,计算固体粉末中Fe2O3的质量.(保留1位小数)
(4)常温下,称取不同铁锈样品溶入足量盐酸,向溶液中加入足量NaOH溶液生成沉淀,然后过滤、洗涤、灼烧,得到Fe2O3固体,实验过程中产品无损失.
实验数据记录如下:
上述实验①②③④所用铁锈均不含杂质,且实验数据可靠.通过计算,分析和比较上表4组数据,给出结论.
(1)已知Fe2O3在高炉中有下列反应:Fe2O3+CO
| 高温 |
a.7:3 b.21:8 c.14:5 d.7:2
(2)若m(Fe):m(O)=3:1,则Fe2O3与FeO的物质的量之比为
(3)3.04g Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,生成的CO2气体通入过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,计算固体粉末中Fe2O3的质量.(保留1位小数)
(4)常温下,称取不同铁锈样品溶入足量盐酸,向溶液中加入足量NaOH溶液生成沉淀,然后过滤、洗涤、灼烧,得到Fe2O3固体,实验过程中产品无损失.
实验数据记录如下:
| 实验序号 | 铁锈质量/g | 氧化铁质量/g |
| ① | 0.856 | 0.640 |
| ② | 1.424 | 1.280 |
| ③ | 0.979 | 0.880 |
| ④ | 1.070 | 0.800 |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)固体混合物为Fe2O3、FeO,假设只有Fe2O3,m (Fe):m (O)=56×2:16×3=7:3,假设只有FeO,则m (Fe):m (O)=56:16=7:2,利用平均值法分析;
(2)m (Fe):m (O)=3:1,设Fe2O3原有1mol,被还原的百分率为x,利用元素的质量比列式解答;
(3)Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,分别发生Fe2O3+3CO
Fe+3CO2,FeO+CO
Fe+CO2,根据生成二氧化碳的物质的量可列方程式计算;
(4)根据固体的质量之差可分别计算水和氧化物的质量,可确定化学式.
(2)m (Fe):m (O)=3:1,设Fe2O3原有1mol,被还原的百分率为x,利用元素的质量比列式解答;
(3)Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,分别发生Fe2O3+3CO
| ||
| ||
(4)根据固体的质量之差可分别计算水和氧化物的质量,可确定化学式.
解答:
解:(1)固体混合物为Fe2O3、FeO,假设只有Fe2O3,m (Fe):m (O)=56×2:16×3=7:3,假设只有FeO,则m (Fe):m (O)=56:16=7:2,
因是二者的混合物,则21:6<m (Fe):m (O)<21:9或7:2<m (Fe):m (O)<7:3,则不可能为a、d,
故答案为:a、d;
(2)m (Fe):m (O)=3:1,设Fe2O3为xmol,FeO为ymol,则
=3,解答x:y=1:4,
设混合物由1molFe2O3和4molFeO组成,由Fe2O3+CO
2FeO+CO2可知,
Fe2O3被CO还原的物质的量2mol,则Fe2O3被CO还原的物质的量分数为
×100%=66.7%,
故答案为:1:4;66.7%;
(3)Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,分别发生Fe2O3+3CO
Fe+3CO2,FeO+CO
Fe+CO2,
生成的CO2气体通入过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,则可知n(CO2)=n(CaCO3)=
=0.05mol,
设Fe2O3和FeO物质的量分别为m、n,
则
,
解得:m=0.01,n=0.02,
则m(Fe2O3)=0.01mol×160g/mol=1.6g,
答:固体粉末中Fe2O3的质量为1.6g;
(4)由质量差值可知①中:n(H2O)=
mol=0.012mol,n(Fe2O3)=
mol=0.004mol,则n(H2O):n(Fe2O3)=3:1,化学式为Fe2O3?3 H2O,
②中:n(H2O)=
mol=0.008mol,n(Fe2O3)=
mol=0.008mol,则n(H2O):n(Fe2O3)=1:1,化学式为Fe2O3?H2O
③中:n(H2O)=
mol=0.0055mol,n(Fe2O3)=
mol=0.0055mol,则n(H2O):n(Fe2O3)=1:1,化学式为Fe2O3?H2O
④中:n(H2O)=
mol=0.015mol,n(Fe2O3)=
mol=0.005mol,则n(H2O):n(Fe2O3)=3:1,化学式为Fe2O3?3H2O
答:结论为①④是Fe2O3?3H2O;②③是Fe2O3?H2O.
因是二者的混合物,则21:6<m (Fe):m (O)<21:9或7:2<m (Fe):m (O)<7:3,则不可能为a、d,
故答案为:a、d;
(2)m (Fe):m (O)=3:1,设Fe2O3为xmol,FeO为ymol,则
| (2x+y)×56 |
| (3x+y)×16 |
设混合物由1molFe2O3和4molFeO组成,由Fe2O3+CO
| 高温 |
Fe2O3被CO还原的物质的量2mol,则Fe2O3被CO还原的物质的量分数为
| 2 |
| 2+1 |
故答案为:1:4;66.7%;
(3)Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,分别发生Fe2O3+3CO
| ||
| ||
生成的CO2气体通入过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,则可知n(CO2)=n(CaCO3)=
| 5.00g |
| 100g/mol |
设Fe2O3和FeO物质的量分别为m、n,
则
|
解得:m=0.01,n=0.02,
则m(Fe2O3)=0.01mol×160g/mol=1.6g,
答:固体粉末中Fe2O3的质量为1.6g;
(4)由质量差值可知①中:n(H2O)=
| 0.856-0.640 |
| 18 |
| 0.640 |
| 160 |
②中:n(H2O)=
| 1.424-1.280 |
| 18 |
| 1.28 |
| 160 |
③中:n(H2O)=
| 0.979-0.880 |
| 18 |
| 0.880 |
| 160 |
④中:n(H2O)=
| 1.070-0.800 |
| 18 |
| 0.800 |
| 160 |
答:结论为①④是Fe2O3?3H2O;②③是Fe2O3?H2O.
点评:本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意结合反应的方程式从质量守恒的角度列式计算,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化学式表示的一定是纯净物的是( )
| A、C3H8 |
| B、C12H22011 |
| C、C2H402 |
D、 |
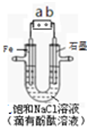 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、1mol NH3含有的电子数10NA |
| C、常温常压下,22.4L的氧气含氧原子数为2NA |
| D、常温下,1L 0.1mol?L-1 AlCl3溶液中含Al3+数为0.1NA |
下列说法正确的是( )
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
 元素及其化合物在生产、生活中具有广泛的用途.
元素及其化合物在生产、生活中具有广泛的用途.