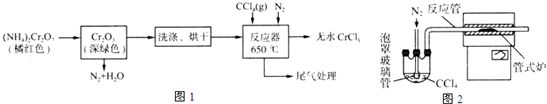
题目内容
6.常温下,下列不发生反应的一组物质是( )①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ①④⑤⑦ | D. | ①②③⑦ |
分析 ①Cu与浓硫酸加热发生氧化还原反应;
②常温下反应生成硅酸钠和水;
③常温发生氧化还原反应生成硝酸铜、二氧化氮和水;
④高温下发生反应;
⑤点燃或加热反应生成四氧化三铁;
⑥常温下反应生成二氧化氮;
⑦加热反应生成二氧化硅.
解答 解:①④⑤⑦均在常温下不能发生反应,而②③⑥常温下发生反应,
故选C.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应是解本题关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.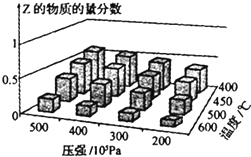 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
17.下列关于钠的说法正确的是( )
| A. | 钠是银白色金属、密度比水略大 | |
| B. | 钠着火时,可用水灭火 | |
| C. | 金属钠在空气中燃烧,生成氧化钠 | |
| D. | 通常情况下,钠的熔点略低于水的沸点 |
14.下列说法或者方程式正确的是( )
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2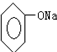 +H2O+CO2→2 +H2O+CO2→2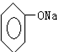 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
11.“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10mol•L-1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
请回答下列问题:
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
18.反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )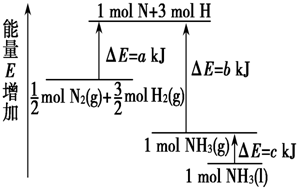

| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
15.下列与化学技术应用有关的说法不正确的是( )
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 为预防碘缺乏病,在食盐中加入碘单质 |
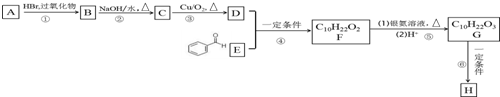
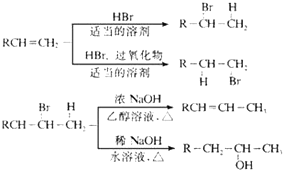
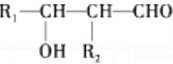
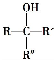 不能被氧化成醛或酮;
不能被氧化成醛或酮;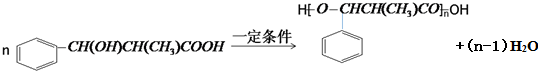
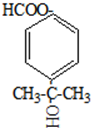 .
.