题目内容
0.3mol的氧气和0.2mol的臭氧(O3),它们的质量 ,它们所含的分子数 ,原子数 ,(以上三空填“相等”或“不相等”)它们的体积比(同温、同压)是 .
考点:阿伏加德罗定律及推论
专题:计算题
分析:根据m=n?M计算质量,然后作比较;根据N=n?NA计算分子数,然后作比较;根据V=n?Vm计算体积比.
解答:
解:根据m=n?M可知,0.3molO2与0.2molO3的质量都为9.6g,故两者的质量相等,
根据N=n?NA可知,0.3molO2与0.2molO3所含的分子数分别为0.3NA,0.2NA,则分子数不等,
0.3mol的氧气和0.2mol的臭氧(O3),原子数都是0.6mol,
根据V=n?Vm可知,同温同压的体积之比等于物质的量之比,所以体积之为3:2,
故答案为:相等;不相等;相等;3:2.
根据N=n?NA可知,0.3molO2与0.2molO3所含的分子数分别为0.3NA,0.2NA,则分子数不等,
0.3mol的氧气和0.2mol的臭氧(O3),原子数都是0.6mol,
根据V=n?Vm可知,同温同压的体积之比等于物质的量之比,所以体积之为3:2,
故答案为:相等;不相等;相等;3:2.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、向次氯酸钙溶液中通入过量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、向碘化亚铁溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
下列物质的使用不涉及化学变化的是( )
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| D、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.

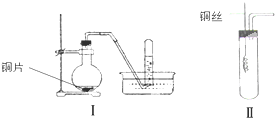 如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.