题目内容
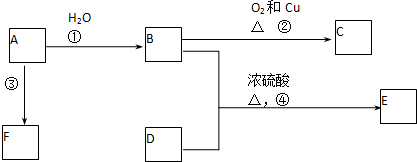
4.有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
已知:
 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基.已知1mol F与足量钠作用产生H2 22.4L(标准状况),则F的分子式是C2H6O2.
(2)G与F的相对分子质量之差为4,则G的性质是ac(填字母).
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式:CH2=CHCH2OOCH、OHCCH2CH2CHO等.
(5)A转化为B和F的化学方程式是
 .
.
分析 F的蒸气密度是相同条件下H2密度的31倍,则F的相对分子质量为31×2=62,1mol F与足量金属钠作用产生H2 物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,说明F中很有2个-OH,去掉2个-OH后剩余原子总相对原子质量为62-34=28,则含有2个C原子,且分子中无甲基,故F为HOCH2CH2OH,G与F的相对分子质量之差为4,则F发生催化氧化生成G为OHC-CHO.A发生水解反应生成B、F,应是酯的水解,则B的分子式应为C4H6O2,结合题给信息可知,B为 ,则A为
,则A为 ,C为
,C为 ,与氢气发生加成反应生成D为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E为CH2=CHCOOH.
,与氢气发生加成反应生成D为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E为CH2=CHCOOH.
解答 解:F的蒸气密度是相同条件下H2密度的31倍,则F的相对分子质量为31×2=62,1mol F与足量金属钠作用产生H2 物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,说明F中很有2个-OH,去掉2个-OH后剩余原子总相对原子质量为62-34=28,则含有2个C原子,且分子中无甲基,故F为HOCH2CH2OH,G与F的相对分子质量之差为4,则F发生催化氧化生成G为OHC-CHO.A发生水解反应生成B、F,应是酯的水解,则B的分子式应为C4H6O2,结合题给信息可知,B为 ,则A为
,则A为 ,C为
,C为 ,与氢气发生加成反应生成D为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E为CH2=CHCOOH.
,与氢气发生加成反应生成D为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E为CH2=CHCOOH.
(1)由上述分析可知,F为HOCH2CH2OH,分子式为:C2H6O2,
故答案为:C2H6O2;
(2)由上述分析可知,G为OHC-CHO,含有-CHO,可发生银镜反应和加成反应,不能发生酯化反应,因含有2个-CHO,则1molG最多可与4mol新制Cu(OH)2发生反应,
故答案为:ac;
(3)D应为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E,则E为CH2=CHCOOH,反应的方程式为CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,
故答案为:CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O;消去;
(4)B为 ,一种不含甲基能发生银镜反应的同分异构体结构简式:CH2=CHCH2OOCH、OHCCH2CH2CHO等,
,一种不含甲基能发生银镜反应的同分异构体结构简式:CH2=CHCH2OOCH、OHCCH2CH2CHO等,
故答案为:CH2=CHCH2OOCH、OHCCH2CH2CHO等;
(5)A为 ,可水解生成
,可水解生成 和乙二醇,反应的方程式为
和乙二醇,反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,关键是确定乙的结构简式,结合分子式进行分析,侧重考查学生分析推理能力,熟练掌握官能团的性质与转化,题目难度中等.

| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
| A. | HF、HClO都是弱酸,HClO3、HClO4均为强酸 | |
| B. | HBr的水溶液有酸性、氧化性、还原性 | |
| C. | HI的水溶液还原性很强,在空气中易被氧化变质 | |
| D. | HX水溶液酸性顺序为:HCl>HBr>HI>HF |
| A. | 用SO2漂白纸浆和草帽辫 | B. | 用硫酸清洗锅炉中的水垢 | ||
| C. | 高温下用焦炭还原SiO2制取粗硅 | D. | 丁达尔效应可以区分溶液与胶体 |
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 采用牺牲阳极的阴极保护法:在海轮外壳连接锌块保护外壳 | |
| C. | 金属在潮湿空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$ H2↑ | |
| D. | 地下钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| A. | 苯酚俗称石炭酸,酸性比碳酸强 | |
| B. | 皮肤上若沾有少量苯酚,正确的处理方法是用70℃热水洗 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 乙醇熔沸点比含相同碳原子的烷烃熔沸点高的主要原因是乙醇分子之间易形成氢键 |
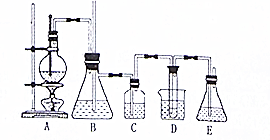 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石).
(2)实验进行时若装置D中的导气管发生堵塞,此时装置B中可观察到的现象为B中的水面下降,玻璃管中的水面上升甚至会溢出.
(3)装置C的试剂瓶中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2.
(4)装置D的试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅.
(5)开始反应时向装置D的烧杯中加入冰水,这是为了降温,防止液溴挥发.
(6)装置E的作用是尾气处理,吸收多余的Br2,防止污染环境.
(7)某学生使用46g乙醇在浓硫酸存在下与足量的液溴充分反应,最终得到1,2一二溴乙烷178.6g,则生成1,2一二溴乙烷的产率为95%.
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.