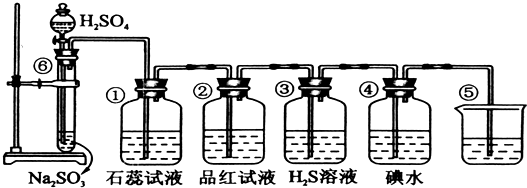
题目内容
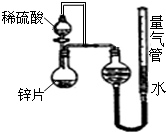 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.(1)圆底烧瓶中发生反应的离子方程式是
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,结果为t1>t2
| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含的杂质可能是(填序号)
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有
考点:探究温度、压强对化学反应速率的影响
专题:实验设计题
分析:(1)①根据反应物和生成物写出离子方程式;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,据此判断;
(3)根据所给装置判断;
(4)测得的反应速率均大于上述实验对应的数据,化学反应速率增大,所含杂质与锌可形成原电池而加快反应速率,据此判断;
(5)根据化学反应速率影响因素判断.
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,据此判断;
(3)根据所给装置判断;
(4)测得的反应速率均大于上述实验对应的数据,化学反应速率增大,所含杂质与锌可形成原电池而加快反应速率,据此判断;
(5)根据化学反应速率影响因素判断.
解答:
(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑;故答案为:Zn+2H+=Zn2++H2↑;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平;故答案为:其他条件不变时,浓度越大,反应速率越快;
(3)题目装置中,装有硫酸的分液漏斗,通过导管连接锥形瓶和分液漏斗上方,即上下压强相同,则实验中向烧瓶中滴入的稀硫酸的体积对测定气体体积无影响,故答案为:无影响;
(4)由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是比锌不活泼的:石墨、银、铜等,故答案为:abc;
(5)化学反应速率的影响因素为:温度、浓度、压强、接触面积和催化剂,因此加快该反应的反应速率还可以升高温度、将锌片换成锌粒或锌粉等,故答案为:升高温度、将锌片换成锌粒或锌粉.
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平;故答案为:其他条件不变时,浓度越大,反应速率越快;
(3)题目装置中,装有硫酸的分液漏斗,通过导管连接锥形瓶和分液漏斗上方,即上下压强相同,则实验中向烧瓶中滴入的稀硫酸的体积对测定气体体积无影响,故答案为:无影响;
(4)由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是比锌不活泼的:石墨、银、铜等,故答案为:abc;
(5)化学反应速率的影响因素为:温度、浓度、压强、接触面积和催化剂,因此加快该反应的反应速率还可以升高温度、将锌片换成锌粒或锌粉等,故答案为:升高温度、将锌片换成锌粒或锌粉.
点评:本题考查化学反应速率的影响因素,难度不大,应熟练掌握相关知识.

练习册系列答案
相关题目
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol?L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol?L-1.若在5mL含有KCl和KI各为0.01mol?L-1的溶液中,加入8mL 0.01mol?L-1 AgNO3溶液(已知Ksp(AgI)=1.23×10-8mol2?L-2,Ksp(AgCl)=1.25×10-5 mol2?L-2),下列叙述正确的是( )
A、混合溶液中c(K+)>c(NO
| ||
B、混合溶液中c(K+)>c(NO
| ||
| C、加入AgNO3溶液时首先生成AgCl沉淀 | ||
D、混合溶液中
|
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol?L-1,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L浓度均为 0.2mol?L-1 的HF和NaF溶液中加入1L 0.2mol?L-1 CaCl2溶液(忽略体积变化),则下列说法中,正确的是( )
| A、25℃时,0.1 mol?L-1 HF溶液中pH=1 |
| B、Ksp(CaF2)随温度和固体质量的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、在原HF和NaF混合液中,2c(Na+)=c(F-)+c(HF) |