题目内容
5.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,在处于同周期的C、D、E三种元素中,E的原子半径最小,通常情况下,五种元素的单质中有三种气体,两种固体.(1)A为H,B为O,C为Na(填写元素符号),D的原子结构示意图为
 .
.(2)试比较D、E两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>H2SO4.
(3)A和B可形成原子个数比为1:1的化合物,其化学式为H2O2.
(4)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
分析 地壳中含量最多的元素是O,B是O;B、D同主族,D是S;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,且A、C同主族,则A是H,C是Na.同周期的C、D、E三元素中,E的原子半径最小,由原子半径变化规律知E是Cl,然后结合物质中化学用语等来解答
解答 解:地壳中含量最多的元素是O,B是O;B、D同主族,D是S;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,且A、C同主族,则A是H,C是Na.同周期的C、D、E三元素中,E的原子半径最小,由原子半径变化规律知E是Cl,
(1)地壳中含量最多的元素是O,B是O;B、D同主族,D是S,D的原子结构示意图为  ;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,且A、C同主族,则A是H,C是Na;故答案为:H O Na
;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,且A、C同主族,则A是H,C是Na;故答案为:H O Na 
(2)非金属性Cl>S,酸性为HClO4>H2SO4,故答案为:HClO4;H2SO4;
(3)A和B可形成原子个数比为1:1的化合物,其化学式为H2O2,故答案为:H2O2
(4)将Cl2单质通入H、O、Na三种元素组成的化合物的水溶液中,写出反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O
点评 本题考查位置、结构、性质的关系,元素的推断为解答本题的关键,涉及知识点较多,把握非金属性与酸性的比较等常考考点即可解答,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.把100ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入amol硫酸钠溶液,恰好使钡离子完全沉淀;另一份加入含有bmol硝酸银溶液,恰好使氯离子完全沉淀,则该混合溶液中钾离子浓度为( )
| A. | 50(b-2a) | B. | (b-2a) | C. | 50(b-a) | D. | 10(b-2a) |
20.实验室配制浓度为2.0mol•L-1 NaOH溶液100mL,下面有关操作及说法正确的是( )
| A. | 配制操作为:称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| B. | 称量 NaOH固体时,应在托盘天平两盘上各放一张大小相同的纸片 | |
| C. | 若所用NaOH固体中有少量Na2O杂质,则造成所配溶液浓度偏高 | |
| D. | 若用10 mol•L-1NaOH溶液来配制,用量筒量取20 mL NaOH浓溶液倒入烧杯后,应该用同一量筒取一定量蒸馏水倒入烧杯中 |
17.下列实验操作能达到实验目的是( )
| A. | 除去AlCl3溶液中的FeCl3杂质的方法:先加入足量浓氨水,过滤,再加入过量盐酸,得到纯净AlCl3溶液 | |
| B. | 可以用金属钠和MgCl2溶液反应置换金属Mg;可以通过化合反应制备Fe(OH)3 | |
| C. | 对某溶液进行焰色反应,火焰呈黄色,则证明该溶液中含有钠盐,可能有钾盐 | |
| D. | 配制氯化铁溶液时,将氯化铁固体溶解在较浓的盐酸中再加水稀释 |
10.下列有机物的命名肯定错误的是( )
| A. | 4-甲基-2-戊烯 | B. | 2,2-二甲基丙烷 | ||
| C. | 2,3,3-三甲基-2-戊烯 | D. | 4-乙基-2-庚烯 |
14.一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.下列判断正确的是( )


| A. | 溶液酸性越强,R 的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和PH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol•L-1•min-1 |
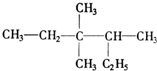 3,3,4-三甲基己烷;
3,3,4-三甲基己烷;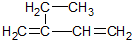 2-乙基-1,3-丁二烯.
2-乙基-1,3-丁二烯.