题目内容
4.配制0.1mol•L-1H2SO4溶液500mL,问需密度1.84g•mL-1、质量分数为98%的浓H2SO4多少毫升?分析 浓硫酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,n(H2SO4)=0.1mol/L×0.5L=0.05mol,溶液稀释前后溶质的物质的量不变,据此计算浓硫酸体积.
解答 解:浓硫酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,n(H2SO4)=0.1mol/L×0.5L=0.05mol,溶液稀释前后溶质的物质的量不变,则浓硫酸体积=$\frac{0.05mol}{18.4mol/L}$≈2.7mL,
答:需密度1.84g•mL-1、质量分数为98%的浓H2SO42.7毫升.
点评 本题考查物质的量浓度有关计算,为高频考点,明确物质的量浓度与密度、质量分数关系公式是解本题关键,侧重考查学生计算能力,注意单位换算,为易错点.

练习册系列答案
相关题目
14.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Al3+离子含有的核外电子数为3NA | |
| B. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 18gH2O中含有的质子数为10NA |
12.选择萃取剂将碘水中的碘萃取出来,这种萃取剂不可能是( )
| A. | 苯 | B. | 四氯化碳 | C. | 酒精 | D. | 汽油 |
9.下列说法正确的是( )
| A. | 按系统命名法 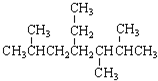 ,的名称为2,5,6-三甲基-4-乙基庚烷 ,的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 苯酚为无色晶体,常因为氧化呈粉红色 |
 .
. ;
;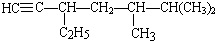 的系统名称为5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称为5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.