题目内容
在通常条件下,下列各组物质的性质排列正确的是( )
| A、熔点:CO2>KCl>SiO2 |
| B、结合质子能力:Cl->CH3COO->OH- |
| C、沸点:乙烷>戊烷>丁烷 |
| D、热稳定性:HF>H2O>NH3 |
考点:晶体熔沸点的比较,同一周期内元素性质的递变规律与原子结构的关系,分子间作用力对物质的状态等方面的影响
专题:
分析:A.一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体;
B.电解质越弱,其相应的阴离子结合质子能力越强;
C.烷烃中碳原子个数越多其熔沸点越高;
D.元素的非金属性越强,其气态氢化物越稳定.
B.电解质越弱,其相应的阴离子结合质子能力越强;
C.烷烃中碳原子个数越多其熔沸点越高;
D.元素的非金属性越强,其气态氢化物越稳定.
解答:
解:A.一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,二氧化碳是分子晶体、KCl是离子晶体、二氧化硅是原子晶体,所以熔点SiO2>KCl>CO2,故A错误;
B.电解质越弱,其相应的阴离子结合质子能力越强,电解质强弱顺序是HCl>CH3COOH>H2O,所以结合质子顺序是Cl-<CH3COO-<OH-,故B错误;
C.烷烃中碳原子个数越多其熔沸点越高,所以沸点戊烷>丁烷>乙烷,故C错误;
D.元素的非金属性越强,其气态氢化物越稳定,非金属性F>O>N,所以热稳定性:HF>H2O>NH3,故D正确;
故选D.
B.电解质越弱,其相应的阴离子结合质子能力越强,电解质强弱顺序是HCl>CH3COOH>H2O,所以结合质子顺序是Cl-<CH3COO-<OH-,故B错误;
C.烷烃中碳原子个数越多其熔沸点越高,所以沸点戊烷>丁烷>乙烷,故C错误;
D.元素的非金属性越强,其气态氢化物越稳定,非金属性F>O>N,所以热稳定性:HF>H2O>NH3,故D正确;
故选D.
点评:本题考查晶体熔沸点高低顺序、电解质的电离等知识点,明确晶体类型与物质熔沸点的关系、氢化物中非金属元素非金属性与稳定性的关系等知识点即可解答,为高考高频点,要熟练掌握.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
下列微粒中,只具有还原性的是( )
| A、Na+ |
| B、F2 |
| C、Cl- |
| D、SO32- |
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中,下列说法正确的是( )
| A、Cl2是还原产物 |
| B、HCl全部被还原 |
| C、KMnO4被氧化 |
| D、HCl既表现还原性又表现酸性 |
下列说法中,正确的是:( )
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
一个电池反应的离子方程式是 Zn+Cu2+═Zn2++Cu,该反应的原电池正确组合是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | HCl |
| A、A | B、B | C、C | D、D |
下列条件下,两瓶气体所含的原子数一定相等的是( )
| A、同质量、不同密度的N2和CO |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的N2O和CO2气体 |
| D、同压强、同体积的N2O和CO2 |
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,欲除去Cu2+,最好选用下列试剂中的( )
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
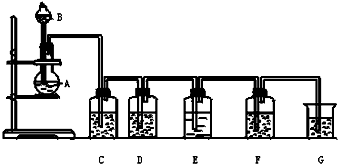 实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:
实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题: