题目内容
下列说法中,正确的是:( )
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
考点:离子化合物的结构特征与性质,化学键
专题:
分析:①在水中氢、氧原子间存在化学键和氢键;
②金属和非金属化合不一定形成离子键,可能形成共价键;
③离子键的实质是阳离子、阴离子间的相互作用力;
④HCl能电离出氢离子和氯离子,但HCl中只存在共价键;
⑤共价化合物中一定不含离子键.
②金属和非金属化合不一定形成离子键,可能形成共价键;
③离子键的实质是阳离子、阴离子间的相互作用力;
④HCl能电离出氢离子和氯离子,但HCl中只存在共价键;
⑤共价化合物中一定不含离子键.
解答:
解:①在水中的每个水分子中H原子和O原子之间存在共价键,但水分子之间存在氢键,故错误;
②金属和非金属化合不一定形成离子键,可能形成共价键,如氯化铝,故错误;
③离子键的实质是阳离子、阴离子间的相互作用力,包含吸引力和排斥力,故错误;
④HCl能电离出氢离子和氯离子,但HCl中H原子和Cl之间以共价键相结合,属于共价键,所以只存在共价键,故错误;
⑤共价化合物只含共价键,所以一定不含离子键,故错误;
故选B.
②金属和非金属化合不一定形成离子键,可能形成共价键,如氯化铝,故错误;
③离子键的实质是阳离子、阴离子间的相互作用力,包含吸引力和排斥力,故错误;
④HCl能电离出氢离子和氯离子,但HCl中H原子和Cl之间以共价键相结合,属于共价键,所以只存在共价键,故错误;
⑤共价化合物只含共价键,所以一定不含离子键,故错误;
故选B.
点评:本题考查化学键,侧重考查基本概念,明确离子键、共价键及离子化合物、共价化合物的关系即可解答,易错选项是④.

练习册系列答案
相关题目
在混合体系中,确认化学反应先后顺序有利于问题解决,下列反应顺序判断正确的是( )
| A、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| C、在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2可以看成:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D、在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
可逆反应达到平衡的根本原因是( )
| A、正逆反应的速率相等 |
| B、正逆反应都还在继续进行 |
| C、正逆反应的速率均为零 |
| D、反应混合物中各组分的浓度相等 |
下列关于各反应类型的关系中,说法正确的是( )
| A、置换反应一定属于氧化还原反应 |
| B、离子反应一定属于氧化还原反应 |
| C、有的复分解反应属于氧化还原反应 |
| D、所有化合反应都属于氧化还原反应 |
在通常条件下,下列各组物质的性质排列正确的是( )
| A、熔点:CO2>KCl>SiO2 |
| B、结合质子能力:Cl->CH3COO->OH- |
| C、沸点:乙烷>戊烷>丁烷 |
| D、热稳定性:HF>H2O>NH3 |
 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )| A、电流计指针不发生偏转 |
| B、Al、Pt两电极有氢气生成 |
| C、Mg、C两电极生成的气体在一定条件下可以恰好完全反应 |
| D、甲池pH减小,乙池pH不变 |
下列表达式错误的是( )
A、甲烷的电子式: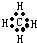 |
B、氮原子的L层电子轨道表示式: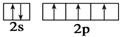 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
