题目内容
16.下列结论错误的是( )| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | |
| D. | 金属性:K>Ca>Mg>Be |
分析 A.非金属性越强,气态氢化物越稳定;
B.一般来说,离子核外的电子层数越多,离子半径越大,具有相同核外电子排布的离子,核电荷数越大离子半径越小;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.同主族元素的单质从上到下,金属性增强,同周期元素的单质从右到左,金属性增强.
解答 解:A.非金属性F>Cl>S>P>Si,非金属性越强,气态氢化物越稳定,故A正确;
B.一般来说,离子核外的电子层数越多,离子半径越大,具有相同核外电子排布的离子,核电荷数越大离子半径越小,则应为K+>S2->Cl->Al3+,故B错误;
C.非金属性Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.同主族元素的单质从上到下,金属性增强,同周期元素的单质从右到左,金属性增强,则金属性:K>Ca>Mg>Be,故D正确.
故选B.
点评 本题综合考查元素周期律知识,侧重于学生的分析能力的考查,为高频考点,注意把握比较的角度以及相关基础知识的积累,难度不大.

练习册系列答案
相关题目
6.下列各项中:①土地沙漠化②酸雨③水资源危机④臭氧层空洞⑤沙尘暴,其中属于因人类生产、生活对环境造成破坏的是( )
| A. | 只有①②⑤ | B. | 只有①②③⑤ | C. | 只有②③④ | D. | 全部 |
7. 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )| A. | ZX2为酸性氧化物,只能与碱溶液反应 | |
| B. | 简单氢化物的热稳定性:Z<W | |
| C. | 化合物YWX中既含离子键,又含共价键 | |
| D. | W的最高价氧化物对应的水化物为强酸 |
4.一定温度下,反应N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
( )
( )
| A. | 恒容充入N2 | B. | 缩小体积使压强增大 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
11.在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍.在这段时间内,用H2表示该反应的平均反应速率是( )
| A. | 0.125mol•L-1•min-1 | B. | 0.100 mol•L-1•s-1 | ||
| C. | 0.200 mol•L-1•min-1 | D. | 0.375 mol•L-1•s-1 |
1.某学生欲通过实验判断A、B、C三块金属的活动性,做了如下实验并得结论:当A与B组成原电池时,A 为电池的正极;当B与C组成原电池时,电流方向为由B到C,据此可知这三种金属的活动性强弱顺序为( )
| A. | A>B>C | B. | A>C>B | C. | C>B>A | D. | B>C>A |
8.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由丙烯与水反应制丙醇 |
2.下列离子方程式正确的是( )
| A. | 过量铁粉溶于稀HNO3中:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| B. | 过量NaHSO4溶液加入到Ba(OH)2溶液中:2H++SO42-+Ba2++2 OH-═2H2O+BaSO4↓ | |
| C. | 少量Cl2通人FeBr2溶液中:2 Br-+Cl2═2 Cl-+Br2 | |
| D. | 少量 AlCl3溶液滴入到氨水中:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
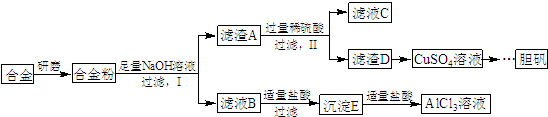
 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.