题目内容
2.氢化钙固体是登山运动员常用的能源供给剂,在实验室中可以用金属钙与氢气加热反应制取.下列说法正确的是( )| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
分析 供氧时发生CaH2+2H2O═Ca(OH)2+2H2↑,氢化钙中H元素的化合价升高,水中H元素的化合价降低,以此来解答.
解答 解:供氧时发生CaH2+2H2O═Ca(OH)2+2H2↑,
A.氢化钙中H元素的化合价升高,为还原剂,故A错误;
B.加热时,氢化钙能跟干燥氧气发生氧化还原反应,生成CaO、水,故B正确;
C.氢化钙(CaH2)含离子键,是离子化合物,固体中不含H-H键,故C错误;
D.金属钙与氢化钙均与水反应生成氢气,滴加水不能鉴别,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应、元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.一种气态烷烃和气态烯烃组成的混合物18g,混合气体的密度是相同状况下氢气密度的11.2倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4g,组成该混合气体的成分可能是( )
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 甲烷和丁烯 |
10.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,放电时的反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O下列结论正确的是( )
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
7.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 液氨汽化时吸热,可作制冷剂 | |
| B. | 氧化铝熔点高,可作耐火材料 | |
| C. | 利用酒精沸点较低,可作消毒杀菌剂 | |
| D. | 利用CO2合成的聚碳酸酯能水解,可作降解塑料 |
11.下列关于电解质导电性的说法中,正确的是( )
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
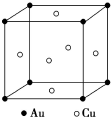 金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).
金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).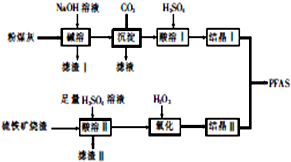 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下: