题目内容
15.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 1mol C12通入足量NaOH溶液中,转移电子数为NA | |
| B. | 18g D2O含有的中子数为10NA | |
| C. | 0.1mol/L的Na2CO3溶液含CO32-数目为0.1NA | |
| D. | 已知白磷(P4)分子结构为正四面体,则1mol P4含共价键数为4NA |
分析 A、氯气和氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子;
B、求出重水的物质的量,然后根据1mol重水中含10mol中子来分析;
C、溶液体积不明确;
D、白磷中含6条P-P键.
解答 解:A、氯气和氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,即NA个,故A正确;
B、18g重水的物质的量为0.9mol,而1mol重水中含10mol中子,故含9NA个中子,故B错误;
C、溶液体积不明确,故溶液中的碳酸根的个数无法计算,故C错误;
D、白磷中含6条P-P键,故1mol白磷中含6NA条P-P键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
5.下列有机化合物与其同分异构体数目一致的是(不考虑立体异构)( )
| 选项 | 有机化合物 | 同分异构体数目 |
| A | 分子式为C8H10的芳香烃 | 3种 |
| B | 分子式为C4H8的烯烃 | 2种 |
| C | 分子式为C6H12O2的羧酸 | 8种 |
| D | 分子式为C4H10O的醇 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
6.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )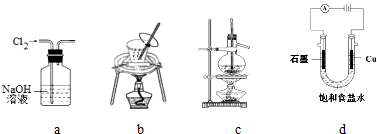

| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置从饱和食盐水中提取氯化钠 | |
| C. | 用图c所示装置制取乙烯气体 | |
| D. | 用图d所示装置制取Cl2、H2 |
3.下列物质中含有离子键的是( )
| A. | CO2 | B. | NaCl | C. | HCl | D. | CH4 |
10.化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
6.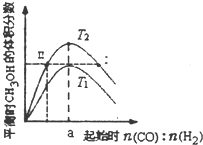 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |


 中,在同一平面上的碳原子最少有9个,最多有14个.
中,在同一平面上的碳原子最少有9个,最多有14个.