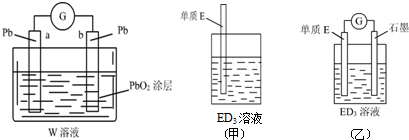
题目内容
9.(1)有以下几种试剂:A.NaOH溶液 B.澄清石灰水 C.品红溶液 D.CaCl2溶液,选用合适的试剂鉴别下列两组物质(填字母代号)①SO2和CO2C②Na2CO3和NaHCO3D
(2)玻璃棒是化学实验中常用的仪器,教科书中下列有关实验过程中,不需要使用玻璃棒进行操作的是(填字母代号)CD
A.配制一定物质的量浓度的溶液 B.浓硫酸的稀释
C.用CCl4萃取碘水中的碘 D.用充满氨气的烧瓶做喷泉实验.
分析 (1)①二氧化硫具有漂白性,而二氧化碳没有,可选用品红溶液鉴别;
②碳酸钠与氯化钙溶液反应生成碳酸钙沉淀,而碳酸氢钠不反应;
(2)A.配制溶液用玻璃棒搅拌和引流;
B.稀释浓硫酸时需要用玻璃棒搅拌;
C.用CCl4萃取碘水中的碘,主要仪器为分液漏斗,不会使用玻璃棒;
D.用充满氨气的烧瓶做喷泉实验,主要使用圆底烧瓶和烧杯,不会使用玻璃棒.
解答 解:(1)①SO2具有漂白性,而CO2不具有漂白性,故可用品红溶液鉴别二者,
故答案为:C;
②Na2CO3与氯化钙溶液反应生成白色沉淀,而NaHCO3不与CaCl2溶液反应,可用CaCl2溶液鉴别二者,
故答案为:D;
(2)A.配制一定物质的量浓度的溶液用玻璃棒搅拌和引流,故A错误;
B.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,故B错误;
C.用CCl4萃取碘水中的碘,主要用到分液漏斗和烧杯,不需要玻璃棒,故C正确;
D.用充满氨气的烧瓶做喷泉实验,主要用到圆底烧瓶、烧杯等,不会用到玻璃棒,故D正确;
故答案为:CD.
点评 本题考查了物质检验鉴别方案的设计,题目难度中等,注意掌握常见物质的性质及鉴别方法,明确玻璃棒在化学实验中的作用为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.下列说法正确的是( )
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
4.下表是元素周期表的一部分:
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式填空:(不得用a~h字母回答)
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
14.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
1.医学上最近合成一种具有抗癌活性的化合物,该物质结构简式为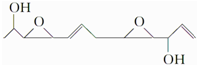 下列关于该化合物的说法正确的是( )
下列关于该化合物的说法正确的是( )
 下列关于该化合物的说法正确的是( )
下列关于该化合物的说法正确的是( )| A. | 分子式为C12H19O4 | B. | 是乙醇的同系物 | ||
| C. | 可发生氧化反应 | D. | 处于同一平面的原子最多有5个 |
18.下列离子方程式的书写正确的是( )
| A. | SO2使酸性KMnO4褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| B. | Fe(OH)2与HNO3溶液的反应:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 足量NaOH与磷酸二氢铵反应:OH-+NH4+=NH3•H2O | |
| D. | 将SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+ |
19.设 NA为阿伏加德罗常数的值.下列说法错误的是( )
| A. | 28 g 由 C2H4 和 C3H6 组成的混合物中含有氢原子的数目为 4 NA | |
| B. | 将 CO2通过 Na2O2,增重 2.8g 时,反应中转移电子数目为 0.1NA | |
| C. | 1 mol[Cu(NH3)4]中含有配位键的数目为 4NA | |
| D. | 标准状况下,11.2 L HF 的分子总数为 0.5NA |
 .
.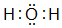 .
.