题目内容
19.设 NA为阿伏加德罗常数的值.下列说法错误的是( )| A. | 28 g 由 C2H4 和 C3H6 组成的混合物中含有氢原子的数目为 4 NA | |
| B. | 将 CO2通过 Na2O2,增重 2.8g 时,反应中转移电子数目为 0.1NA | |
| C. | 1 mol[Cu(NH3)4]中含有配位键的数目为 4NA | |
| D. | 标准状况下,11.2 L HF 的分子总数为 0.5NA |
分析 A、C2H4 和 C3H6 的最简式均为CH2;
B、过氧化钠和二氧化碳反应时,1mol二氧化碳参与反应,增重的是1molCO的质量,即28g;
C、根据1mol[Cu(NH3)4]2+中含有4mol配位键判断;
D、标况下HF为液体.
解答 解:A、C2H4 和 C3H6 的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,故含氢原子为4NA个,故A正确;
B、过氧化钠和二氧化碳反应时,1mol二氧化碳参与反应,增重的是1molCO的质量,即28g,转移1mol电子,故当增重2.8g时,转移0.1mol电子即0.1NA个,故B正确‘
C、1mol[Cu(NH3)4]2+中含配位键4mol,含有配位键数目为4NA,故C正确;
D、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
10.将乙醇滴入热的浓硫酸中,发生反应:C2H5OH+6H2SO4=6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )
| A. | 氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |
7.交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,因为酒中的乙醇分子能使橙红色的重铬酸钾变为绿色的物质.在K2Cr2O7中铬(Cr)元素的化合价是( )
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
14.将下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )
| A. | 硫酸 纯碱 孔雀石[Cu2(OH)2CO3] | B. | 硝酸 烧碱 硫酸钡 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
4.下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
| A. | SiO2(CuO):HCl | B. | MgO(Al2O3):NaOH溶液 | ||
| C. | Na2SiO3溶液(Na2CO3):过量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |
11. 常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )
 常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )| A. | 原混合酸中NO3-的物质的量为0.2mol | |
| B. | 原混合酸中H2SO4物质的量浓度为2mol•L-1 | |
| C. | OA段与BC段反应中电子转移的物质的量之比为2:1 | |
| D. | 取20ml原混合酸加水稀释至1L后溶液的pH=1 |
8.核磁共振仪测定某有机物的结构,到如图所示的核磁共振氢谱,则该有机物可能是( )

| A. | C2H5OH | B. |  | C. |  | D. |  |

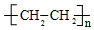 ;
;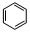 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$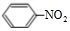 +H2O.
+H2O. ;
; .
.