题目内容
20.化工厂经常用浓氨水检验管道是否漏氯气,其化学反应方程式为:3Cl2+8NH3=6ClNH4+N2,该反应的氧化剂是Cl2,还原剂是NH3,氧化剂与被氧化的物质的量之比为3:2.分析 3Cl2+8NH3═6NH4Cl+N2中,Cl元素的化合价降低,N元素的化合价升高,以此来解答.
解答 解:3Cl2+8NH3═6NH4Cl+N2中,Cl元素的化合价降低,N元素的化合价升高,则氧化剂为Cl2,还原剂是NH3,由反应可知3mol氧化剂与2mol还原剂反应电子守恒,则氧化剂与还原剂的物质的量之比为3:2,
故答案为:Cl2;NH3;3:2.
点评 本题考查氧化还原反应,为高考常考考点,侧重基本概念的考查,明确反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
11.向含有amolNH4HSO4的溶液中加入bmolNaOH.下列说法不正确的是( )
| A. | 当a≥b时,发生的离子反应为H++OH-=H2O | |
| B. | 当5a=4b时,发生的离子反应为4NH4++H++5OH-=4NH3•H2O+H2O | |
| C. | 当a≤b≤$\frac{3}{2}$a时,发生的离子反应为(b-a)NH4++aH++bOH-=(b-a)NH3•H2O+aH2O | |
| D. | 当a/2<b<a时,溶液中Na+、NH4+与H+的物质的量之比为b:a:(a-b) |
8.下列关于金属的冶炼叙述错误的是( )
| A. | 工业上用电解熔融的氯化钠来制备金属钠 | |
| B. | 工业上用电解熔融的氯化铝来制备金属铝 | |
| C. | 工业上用电解熔融的氯化镁来制备金属镁 | |
| D. | 工业上可用一氧化碳还原赤铁矿来制得铁 |
15.下列物质中,能使湿润的淀粉碘化钾试纸变蓝的是( )
| A. | 氯化钠溶液 | B. | 碘水 | C. | 新制盐酸 | D. | 溴化钠溶液 |
5.下列实验正确的是( )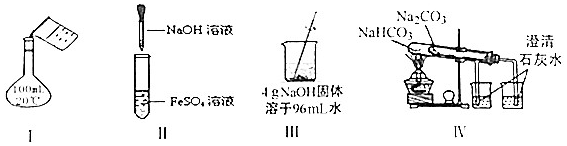

| A. | 实验Ⅰ:配制150mL0.10mol/L盐酸 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:配制4%NaOH溶液 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
7.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
5.设NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1molNH4+所含质子数为10 NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温常压下,22.4 LSO2所含的分子数为NA | |
| D. | 常温常压下,32 gO2和O3的混合气体所含原子数为 2NA |