题目内容
5.设NA表示阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 1molNH4+所含质子数为10 NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温常压下,22.4 LSO2所含的分子数为NA | |
| D. | 常温常压下,32 gO2和O3的混合气体所含原子数为 2NA |
分析 A、铵根离子中含11个质子;
B、求出硫酸氢钾的物质的量,然后根据硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、氧气和臭氧均由氧原子构成.
解答 解:A、铵根离子中含11个质子,故1mol铵根离子中含11NA个质子,故A错误;
B、6.8g硫酸氢钾的物质的量为0.05mol,而硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根,故0.05mol液体硫酸氢钾中含0.05NA个阳离子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化硫的物质的量小于1mol,则分子个数小于NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故32g氧气和臭氧的混合物中含有的氧原子的物质的量为2mol,个数为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
16.已知反应:已知①C(s,石墨)=C(s,金刚石)△H>0,②在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol,下列有关说法正确的是( )
| A. | 金刚石与互为石墨同分异构体 | |
| B. | 石墨比金刚石稳定 | |
| C. | 浓硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ | |
| D. | 稀硫酸和稀Ba(OH)2溶液反应生成1molH2O时的热效应是-57.3kJ |
13.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol.由此判断CO的燃烧热是( )
| A. | 283.0kJ/mol | B. | -566.0kJ/mol | C. | 283.0kJ | D. | 566.0kJ/mol |
10.标准状况下V L氨气溶解在1L水中(水的密度为1g•mL-1),所得溶液密度为ρ g•mL-1,质量分数为w,物质的量浓度为c mol•L-1,则下列关系中不正确的是( )
| A. | w=$\frac{17c}{1000ρ}$ | B. | w=$\frac{17V}{17V+22400}$ | ||
| C. | c=$\frac{1000Vρ}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |
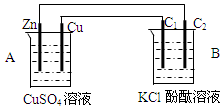 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题