题目内容
16.甲、乙、丙、丁是四种短周期元素,甲原子中K层与M层电子数相等;乙是原子的半径最小的元素;丙原子获得一个电子后核外电子排布和Ar原子结构相同;丁和乙两元素可以形成原子个数比为1:1和1:2两种化合物,请回答:(1)甲是Mg元素(填元素符号),用电子式表示甲与丙形成化合物的过程:
 ;
;(2)乙是H元素(填元素符号),它在周期表中的位置为第一周期第IA族.
(3)丙是氯元素(填元素名称),最高价氧化物对应水化物的化学式是HClO4;
(4)丁是氧元素(填元素名称),乙与丁两种元素可组成的具有强氧化性的物质的电子式是
 .
.
分析 甲、乙、丙、丁是四种短周期元素,甲原子中K层与M层电子数相等,则甲的原子核外电子分三层排布,最外层电子数为2,所以甲为Mg;乙是原子的半径最小的元素,则乙为H元素;丙原子获得一个电子后核外电子排布和Ar原子结构相同,则丙的核外有17个电子,即丙为Cl元素;丁和H两元素可以形成原子个数比为1:1和1:2两种化合物,则丁为O元素;再结合元素周期律解答.
解答 解:甲、乙、丙、丁是四种短周期元素,甲原子中K层与M层电子数相等,则甲的原子核外电子分三层排布,最外层电子数为2,所以甲为Mg;乙是原子的半径最小的元素,则乙为H元素;丙原子获得一个电子后核外电子排布和Ar原子结构相同,则丙的核外有17个电子,即丙为Cl元素;丁和H两元素可以形成原子个数比为1:1和1:2两种化合物,则丁为O元素;
(1)由分析可知,甲为Mg元素,Mg与Cl形成的化合物为氯化镁,MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,
,
故答案为:Mg; ;
;
(2)乙为H元素,在周期表中位于第一周期第IA族;
故答案为:H;第一周期第IA族;
(3)丙为Cl元素,其名称为氯,氯元素的最高价氧化物的水化物为高氯酸,化学式为:HClO4;
故答案为:氯;HClO4;
(4)丁为氧元素,O与H元素形成的具有强氧化性的物质为过氧化氢,过氧化氢为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,
,
故答案为:氧; .
.
点评 本题考查原子结构和元素性质,题目难度中等,根据原子结构确定元素是解题的关键,需要学生熟练掌握核外电子排布规律,有利于基础知识的巩固.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
7. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的某一位置.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至溶液刚好变色,测得盐酸的体积为V1mL.
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是未用标准液润洗酸式滴定管由此造成的测定结果偏高(偏高、偏低或无影响)
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
请计算待测烧碱溶液的浓度:0.0800mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的某一位置.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至溶液刚好变色,测得盐酸的体积为V1mL.
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是未用标准液润洗酸式滴定管由此造成的测定结果偏高(偏高、偏低或无影响)
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
4.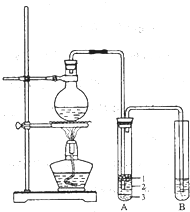 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如图的装置.
根据题意完成下列填空:有关数据列表如下:
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇和2:1的硫酸.配制体积比2:1的硫酸所用的仪器为abc选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第3层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加入d选填编号)然后再进行分液一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:反应会产生Br2,腐蚀橡胶;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为66.8%.
 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如图的装置.
根据题意完成下列填空:有关数据列表如下:
| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第3层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加入d选填编号)然后再进行分液一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:反应会产生Br2,腐蚀橡胶;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为66.8%.
11.下列有关能量转换的说法正确的是 ( )
| A. | 煤燃烧是热能转化为化学能的过程 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 | |
| D. | 化石燃料属于一次能源,电能属于二次能源 |
1.关于下列各装置图的叙述中,正确的是( )
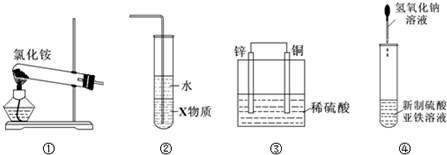

| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
8.下列物质属于同系物的是( )
| A. | CH3CH2Cl与CH3CH2CH2Br | B. |  与 与 | ||
| C. | 乙酸与HCOOCH3 | D. | CH3CH2CH2OH与CH3OH |
5.下列表中括号内的物质为所含的少量杂质,请选用最佳的试剂和操作方法将杂质除去,将对应的编号填入表中.试剂:a生石灰,b 溴水,c饱和碳酸钠溶液,d 酸性高锰酸钾溶液,e水.操作方法:A分液,B洗气,C蒸馏,D结晶.
| 需加入的试剂 | 操作方法 | |
| CH3CH2OH(水) | 蒸馏 | |
| 乙烷(乙烯) | 洗气 | |
| 乙酸乙酯(乙酸,乙醇) |