题目内容
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
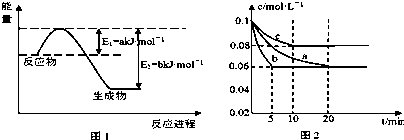
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-c kJ?mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)如图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;
合成氨的反应:N2(g)+3H2(g)═2NH3(g)△H<0
①计算在a达平衡时H2的转化率为 ;
②由如图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
①试确定K1的相对大小,K1 4.1x106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母).
A.容器内NH3的浓度保持不变
B.2υ( N2)正=υ( H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) .
②25℃时,将pH=x氨水与pH=y的硫酸(且x+y=14,x>11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-)
D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)

(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-c kJ?mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式
(2)如图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;
合成氨的反应:N2(g)+3H2(g)═2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
②由如图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内NH3的浓度保持不变
B.2υ( N2)正=υ( H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 )
②25℃时,将pH=x氨水与pH=y的硫酸(且x+y=14,x>11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-)
D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
考点:热化学方程式,化学平衡状态的判断,化学平衡的计算,离子浓度大小的比较
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)依据图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图,书写NO2和CO反应生成CO2和NO热化学方程式,根据盖斯定律结合已知方程式书写CO将NO2还原至N2时的热化学方程式;
(2)①N2的浓度随时间的变化曲线分析,平衡后氮气的浓度变化为0.04mol/L,氢气的变化浓度为0.12mol/L,依据转化率概念计算;
②合成氨是放热反应,c曲线氮气平衡浓度增大说明平衡逆向进行,改变的是温度;b曲线和a曲线是相同的平衡状态,但达到平衡的时间少,说明是催化剂的作用;
(3)①依据合成氨是放热反应,温度升高平衡逆向进行分析平衡常数;
②平衡标志是整正逆反应速率相同,各成分的浓度保持不变分析选项;
(4)①氯化铵溶液中铵根两者水解显酸性;
②依据一水合氨存在电离平衡,x+y=14说明平衡状态下氢氧根离子和硫酸溶液中氢离子浓度相同,一水合氨电离平衡正向进行,溶液呈碱性,离子浓度关系可以依据溶液中的电荷守恒方向判断;
(2)①N2的浓度随时间的变化曲线分析,平衡后氮气的浓度变化为0.04mol/L,氢气的变化浓度为0.12mol/L,依据转化率概念计算;
②合成氨是放热反应,c曲线氮气平衡浓度增大说明平衡逆向进行,改变的是温度;b曲线和a曲线是相同的平衡状态,但达到平衡的时间少,说明是催化剂的作用;
(3)①依据合成氨是放热反应,温度升高平衡逆向进行分析平衡常数;
②平衡标志是整正逆反应速率相同,各成分的浓度保持不变分析选项;
(4)①氯化铵溶液中铵根两者水解显酸性;
②依据一水合氨存在电离平衡,x+y=14说明平衡状态下氢氧根离子和硫酸溶液中氢离子浓度相同,一水合氨电离平衡正向进行,溶液呈碱性,离子浓度关系可以依据溶液中的电荷守恒方向判断;
解答:
解:(1)依据图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图,1mol NO2和1mol CO反应生成CO2和NO反应焓变=aKJ/mol-bKJ/mol=(a-b)KJ/mol,所以
①NO2(g)+CO(g)=CO2(g)+NO(g)△H=(a-b)KJ/mol,
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-c kJ?mol-1(c>0),
将①×2+②得:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ?mol-1,
故答案为:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ?mol-1;
(2)①N2的浓度随时间的变化曲线分析,平衡后氮气的浓度变化为0.04mol/L,氢气的变化浓度为0.12mol/L,反应氢气转化率=
×100%=40%,
故答案为:40%;
②合成氨是放热反应,c曲线氮气平衡浓度增大说明平衡逆向进行,改变的是温度;b曲线和a曲线是相同的平衡状态,但达到平衡的时间少,说明是催化剂的作用,
故答案为:升高温度;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同;
(3)①合成氨是放热反应,温度升高平衡逆向进行,平衡常数减小所以K1<4.1x106,
故答案为:<;
②A.容器内NH3的浓度保持不变,是平衡的标志,故A正确;
B.反应速率之比等于化学方程式系数之比,当v( N2)(正)=3v( H2)(逆)时,说明氢气的正逆反应速率相同,故B错误;
C.反应前后是气体压强变化的反应,容器内压强保持不变,说明反应达到平衡,故C正确;
D.反应过程中气体质量不变,体积不变,混合气体的密度保持不变不能说明反应达到平衡,故D错误;
故选AC.
(4)①NH4Cl溶液呈酸性的原因是铵根离子水解呈酸性,反应的离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+;
②一水合氨存在电离平衡,x+y=14说明平衡状态下氢氧根离子和硫酸溶液中氢离子浓度相同,一水合氨电离平衡正向进行,溶液呈碱性,铵根离子浓度大于硫酸根离子浓度,氢氧根离子浓度大于氢离子浓度,选项B正确,AD错误;溶液中存在电荷守恒为c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-),故C正确;
故选BC.
①NO2(g)+CO(g)=CO2(g)+NO(g)△H=(a-b)KJ/mol,
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-c kJ?mol-1(c>0),
将①×2+②得:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ?mol-1,
故答案为:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ?mol-1;
(2)①N2的浓度随时间的变化曲线分析,平衡后氮气的浓度变化为0.04mol/L,氢气的变化浓度为0.12mol/L,反应氢气转化率=
| 0.12mol/L |
| 0.3mol/L |
故答案为:40%;
②合成氨是放热反应,c曲线氮气平衡浓度增大说明平衡逆向进行,改变的是温度;b曲线和a曲线是相同的平衡状态,但达到平衡的时间少,说明是催化剂的作用,
故答案为:升高温度;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同;
(3)①合成氨是放热反应,温度升高平衡逆向进行,平衡常数减小所以K1<4.1x106,
故答案为:<;
②A.容器内NH3的浓度保持不变,是平衡的标志,故A正确;
B.反应速率之比等于化学方程式系数之比,当v( N2)(正)=3v( H2)(逆)时,说明氢气的正逆反应速率相同,故B错误;
C.反应前后是气体压强变化的反应,容器内压强保持不变,说明反应达到平衡,故C正确;
D.反应过程中气体质量不变,体积不变,混合气体的密度保持不变不能说明反应达到平衡,故D错误;
故选AC.
(4)①NH4Cl溶液呈酸性的原因是铵根离子水解呈酸性,反应的离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+;
②一水合氨存在电离平衡,x+y=14说明平衡状态下氢氧根离子和硫酸溶液中氢离子浓度相同,一水合氨电离平衡正向进行,溶液呈碱性,铵根离子浓度大于硫酸根离子浓度,氢氧根离子浓度大于氢离子浓度,选项B正确,AD错误;溶液中存在电荷守恒为c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-),故C正确;
故选BC.
点评:本题考查了热化学方程式的书写,图象分析判断,盖斯定律计算应用,化学平衡影响因素的分析判断平衡标志理解应用,盐类水解应用酸碱反应注意弱电解质的电离平衡影响,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列实验基本操作正确的是( )
| A、用碱式滴定管量取0.10 mol?L-1的Na2CO3溶液22.10 mL |
| B、配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C、用广范pH试纸测某HCl溶液pH=3.6 |
| D、用玻璃棒蘸取HCl溶液滴到湿润的pH试纸上,测其pH |
用下列实验装置进行相应实验,能达到实验目的是( )
A、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、 分离CCl4萃取溴水后已分层的有机层和水层 |
D、 装置制取少量Cl2气体 |
下列说法正确的是( )
| A、C2H2的电子式为H:C:::C:H |
| B、酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C、鸡蛋白溶液中滴加饱和硫酸铵溶液,出现沉淀,该过程属于蛋白质的盐析 |
| D、6个碳原子形成的烃分子中,最多有5个碳碳单键 |

 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.
