题目内容
已知A、B、C、D、E为五种短周期元素,原子序数依次增大.其中A元素的原子核内只有1个质子;B是化合物种类最多的元素;C原子的最外层电子数是次外层电子数的3倍,D是短周期中最活泼的金属,E的最高价氧化物对应的水化物酸性最强.
(1)写出以上元素符号A 、B 、C 、D .
(2)A元素有三种核素可用化学符号表示 、 、 ,E在元素周期表中的位置是第 周期,第 族.
(3)BC2和D2C2反应的化学方程式是 .
(1)写出以上元素符号A
(2)A元素有三种核素可用化学符号表示
(3)BC2和D2C2反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子核内只有一个质子,则A为H元素;
B是化合物种类最多的元素,则B为C元素;
C原子的最外层电子数是次外层电子数的3倍,则原子核外各层电子数分别为2、6,应为O元素;
D是短周期中最活泼的金属,应为第三周期ⅠA族元素,则D为Na元素;
E的最高价氧化物对应的水化物酸性最强,该酸为高氯酸,则E为Cl元素,
根据以上分析并结合元素周期律知识进行解答.
B是化合物种类最多的元素,则B为C元素;
C原子的最外层电子数是次外层电子数的3倍,则原子核外各层电子数分别为2、6,应为O元素;
D是短周期中最活泼的金属,应为第三周期ⅠA族元素,则D为Na元素;
E的最高价氧化物对应的水化物酸性最强,该酸为高氯酸,则E为Cl元素,
根据以上分析并结合元素周期律知识进行解答.
解答:
解:(1)A原子核内只有一个质子,则A为H元素;B是化合物种类最多的元素,则B为C元素;C原子的最外层电子数是次外层电子数的3倍,则原子核外各层电子数分别为2、6,应为O元素;D是短周期中最活泼的金属,应为第三周期ⅠA族元素,则DNa元素;E的最高价氧化物对应的水化物酸性最强,该酸为高氯酸,则E为Cl元素,
根据分析可知,A为H元素、B为C元素、C为O元素、D为Na元素、E为Cl元素,
故答案为:H;C;ONa;
(2)为H元素,H元素的三种核素分别为氕、氘、氚,对应的化学符号分别为:H、D、T;
E为Cl元素,其原子序数为17,核外含有3个电子层,最外层电子数为7,位于周期表中第三周期ⅤⅡ族,
故答案为:H;D;T;三;ⅤⅡ;
(3)B为C元素、C为O元素、D为Na元素,BC2为二氧化碳,D2C2为过氧化钠,二者反应上次碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
根据分析可知,A为H元素、B为C元素、C为O元素、D为Na元素、E为Cl元素,
故答案为:H;C;ONa;
(2)为H元素,H元素的三种核素分别为氕、氘、氚,对应的化学符号分别为:H、D、T;
E为Cl元素,其原子序数为17,核外含有3个电子层,最外层电子数为7,位于周期表中第三周期ⅤⅡ族,
故答案为:H;D;T;三;ⅤⅡ;
(3)B为C元素、C为O元素、D为Na元素,BC2为二氧化碳,D2C2为过氧化钠,二者反应上次碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律之间的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
室温时,下列各表述与示意图一致的是( )


| A、图甲表示在纯水中加人0.0lmol.L-1NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mLpH=2的HCl和CH3COOH加水稀释到1000 mL时pH变化与水的体积的变化关系 |
下列叙述正确的是( )
| A、原电池中阳离子向负极移动 |
| B、用铝质铆钉接铁板,铁易被腐蚀 |
| C、粗铜精炼时,粗铜接直流电源的正极 |
| D、白铁(镀锌)的表面一旦破损,铁腐蚀加快 |
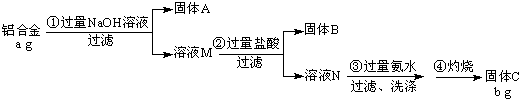
 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
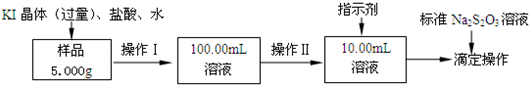
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白. 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行: