题目内容
(1)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子[Cu(H2O)4]2+的配体是 .
(2)根据价层电子对互斥理论及杂化轨道理论判断下列问题:
①NH3中心原子的价层电子对数为 ,杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为 .
②SO3分子中,中心原子的价层电子对数为 ,杂化方式为 杂化,分子的立体构型为 ,是 分子(填极性或非极性)
(2)根据价层电子对互斥理论及杂化轨道理论判断下列问题:
①NH3中心原子的价层电子对数为
②SO3分子中,中心原子的价层电子对数为
考点:配合物的成键情况
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)配合物中中心原子提供空轨道,配体提供孤电子对;
(2)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
(2)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答:
解:(1)在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子;配离子[Cu(H2O)4]2+的配体是H2O,
故答案为:Fe3+;H2O;
(2)①氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
(5-3×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形,由于含有一个孤电子对,所以其空间构型为三角锥形,
故答案为:4;sp3;四面体形;三角锥形;
②三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+
(6-3×2)=3,因此N采取sp2杂化,且不含孤电子对,所以空间构型为平面正三角形结构,非对称性结构,属于由极性键构成的非极性分子,
故答案为:3;sp2;平面正三角形;非极性.
故答案为:Fe3+;H2O;
(2)①氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
| 1 |
| 2 |
故答案为:4;sp3;四面体形;三角锥形;
②三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+
| 1 |
| 2 |
故答案为:3;sp2;平面正三角形;非极性.
点评:本题考查了粒子空间构型的判断,根据价层电子对互斥理论来分析解答即可,注意孤电子对个数的计算方法,为易错点.

练习册系列答案
相关题目
将铁屑溶于过量的盐酸后,再加入下列物质,会有三价铁生成的是( )
| A、硫酸 | B、磷酸 |
| C、硝酸锌 | D、氯化铜 |
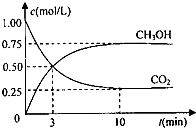 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.