��Ŀ����
A��B��C��D��E����Ԫ�ص����ʻ�ṹ��Ϣ���±����������Ϣ�ش��������⣮
��1��д��AԪ�صĵ�����ˮ��Ӧ�����ӷ���ʽ ������3.9g�õ���������ˮ��Ӧ���ڱ�״������������ L��
��2���õ���ʽ��ʾEԪ���γ��⻯��Ĺ� ��
��3��д��һ��֤�ݣ�˵��E�ķǽ����Ա�Dǿ�������û�ѧ��Ӧ��֤�������û�ѧ����ʽ��ʾ����֤�ݣ� ��
��4����A��D�γɻ��������Һ�У��μ�����ϡ���ᣬȻ���ٵμ�����һ��Ũ�ȵ�˫��ˮ����Һ��Ϊ�ػ�ɫ��д����Ӧ�����ӷ���ʽ �������DԪ�صĵ��ʴ���ˮ��Һ����ȡ����������ѡ�õ���ȡ���� ����������ţ�
�ٱ������������Ȼ�̼
��5���ؿ��к������Ľ���Ԫ����BԪ�صĺ���ɫ�������ڸ������ܷ�Ӧ����������ұ��B���ʣ��˷�Ӧ�Ļ�ѧ����ʽΪ ��������Ӧ�ﰴ�շ�Ӧ��������ϵ��ϣ�ƽ���ֳ����ݣ�һ���ڸ����³�ַ�Ӧ���ڲ����м���ϡ���ᣬ���ɱ�״���µ�����3.36L������һ����ֱ�Ӽ�������2mol/L������������Һ����Ҫ��������������Һ�����Ϊ mL��
| Ԫ�� | A | B | D | E |
| ���� �ṹ ��Ϣ | ���ʼ����ε���ɫ��ӦΪ��ɫ������ɫ�겣���۲죩 | ��ҵ���������Ľ������ڳ�ʪ����������ʴ�����ɺ���ɫ��ĩ״���ʣ� | ������������Һ����ɫ�� | ����Ϊ˫ԭ�ӷ��ӣ���������Һ̬���������л��ܼ��� |
��2���õ���ʽ��ʾEԪ���γ��⻯��Ĺ�
��3��д��һ��֤�ݣ�˵��E�ķǽ����Ա�Dǿ�������û�ѧ��Ӧ��֤�������û�ѧ����ʽ��ʾ����֤�ݣ�
��4����A��D�γɻ��������Һ�У��μ�����ϡ���ᣬȻ���ٵμ�����һ��Ũ�ȵ�˫��ˮ����Һ��Ϊ�ػ�ɫ��д����Ӧ�����ӷ���ʽ
�ٱ������������Ȼ�̼
��5���ؿ��к������Ľ���Ԫ����BԪ�صĺ���ɫ�������ڸ������ܷ�Ӧ����������ұ��B���ʣ��˷�Ӧ�Ļ�ѧ����ʽΪ
���㣺������ƶ�
ר�⣺�ƶ���
������A���ʼ����ε���ɫ��ӦΪ��ɫ��ӦΪKԪ�أ�B��ҵ���������Ľ������ڳ�ʪ����������ʴ�����ɺ���ɫ��ĩ״���ʣ�BӦΪFe��D������������Һ����ɫ��ӦΪI2��E����Ϊ˫ԭ�ӷ��ӣ���������Һ̬���������л��ܼ���ӦΪBr2��
��1���غ�ˮ��Ӧ�����������غ���������Ϸ�Ӧ�ķ���ʽ���㣻
��2��EΪBr��HBrΪ���ۻ����
��3���ɸ��ݵ���֮����û���Ӧ�����жϣ�
��4�����������£��������������KI����I2��������ȡ�ķ������룻
��5��Ϊ���ȷ�Ӧ����Ϸ�Ӧ�ķ���ʽ���㣮
��1���غ�ˮ��Ӧ�����������غ���������Ϸ�Ӧ�ķ���ʽ���㣻
��2��EΪBr��HBrΪ���ۻ����
��3���ɸ��ݵ���֮����û���Ӧ�����жϣ�
��4�����������£��������������KI����I2��������ȡ�ķ������룻
��5��Ϊ���ȷ�Ӧ����Ϸ�Ӧ�ķ���ʽ���㣮
���
�⣺A���ʼ����ε���ɫ��ӦΪ��ɫ��ӦΪKԪ�أ�B��ҵ���������Ľ������ڳ�ʪ����������ʴ�����ɺ���ɫ��ĩ״���ʣ�BӦΪFe��D������������Һ����ɫ��ӦΪI2��E����Ϊ˫ԭ�ӷ��ӣ���������Һ̬���������л��ܼ���ӦΪBr2��
��1���غ�ˮ��Ӧ�����������غ�����������ʽΪ��2K+2H2O=2K++2OH-+H2����n��K��=
=0.1mol���ɷ���ʽ��֪��������0.05mol��
�����Ϊ0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��2K+2H2O=2K++2OH-+H2����1.12��
��2��EΪBr��HBrΪ���ۻ�����õ���ʽ��ʾ���γɹ���Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3���ɸ��ݵ���֮����û���Ӧ�ȽϷǽ����Ե�ǿ����Ԫ�صķǽ�����Խǿ����Ӧ�ĵ��ʵ�������Խǿ���ɽ���ˮ�μӵ�KI������ֽ������ֽ����ɫ����֤��Br�ķǽ�����ǿ������ʽΪBr2+2KI=2KBr+I2���ʴ�Ϊ��Br2+2KI=2KBr+I2��
��4�����������£��������������KI����I2������ʽΪ2I-+2H++H2O2=I2+2H2O��������ȡ�ķ������룬��ȡ��Ӧ������ˮ�����ñ������Ȼ�̼��
�ʴ�Ϊ��2I-+2H++H2O2=I2+2H2O���٢ۣ�
��5��Ϊ���ȷ�Ӧ����Ӧ�ķ���ʽΪ2Al+Fe2O3
2Fe+Al2O3��
һ���ڸ����³�ַ�Ӧ���ڲ����м���ϡ���ᣬ���ɱ�״���µ�����3.36L����ӦΪFe��H2��n��H2��=
=0.15mol��
��n��Fe��=0.15mol���ɷ���ʽ2Al+Fe2O3
2Fe+Al2O3��֪��n��Al��=0.15mol����������2mol/L������������Һ������2Al+2NaOH+2H2O=2NaAlO2+3H2������������������0.15mol����Һ���Ϊ
=0.075L=75mL��
�ʴ�Ϊ��2Al+Fe2O3
2Fe+Al2O3��75��
��1���غ�ˮ��Ӧ�����������غ�����������ʽΪ��2K+2H2O=2K++2OH-+H2����n��K��=
| 3.9g |
| 39g/mol |
�����Ϊ0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��2K+2H2O=2K++2OH-+H2����1.12��
��2��EΪBr��HBrΪ���ۻ�����õ���ʽ��ʾ���γɹ���Ϊ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����3���ɸ��ݵ���֮����û���Ӧ�ȽϷǽ����Ե�ǿ����Ԫ�صķǽ�����Խǿ����Ӧ�ĵ��ʵ�������Խǿ���ɽ���ˮ�μӵ�KI������ֽ������ֽ����ɫ����֤��Br�ķǽ�����ǿ������ʽΪBr2+2KI=2KBr+I2���ʴ�Ϊ��Br2+2KI=2KBr+I2��
��4�����������£��������������KI����I2������ʽΪ2I-+2H++H2O2=I2+2H2O��������ȡ�ķ������룬��ȡ��Ӧ������ˮ�����ñ������Ȼ�̼��
�ʴ�Ϊ��2I-+2H++H2O2=I2+2H2O���٢ۣ�
��5��Ϊ���ȷ�Ӧ����Ӧ�ķ���ʽΪ2Al+Fe2O3
| ||
һ���ڸ����³�ַ�Ӧ���ڲ����м���ϡ���ᣬ���ɱ�״���µ�����3.36L����ӦΪFe��H2��n��H2��=
| 3.36L |
| 22.4L/mol |
��n��Fe��=0.15mol���ɷ���ʽ2Al+Fe2O3
| ||
| 0.15mol |
| 2mol/L |
�ʴ�Ϊ��2Al+Fe2O3
| ||
���������⿼��������ƶϣ�Ϊ�߿��������ͣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע��������ʵ����ʣ�Ϊ������Ĺؼ����Ѷ��еȣ�

��ϰ��ϵ�д�
 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
�����Ŀ
����˵������ȷ���ǣ�������
| A������ϩ�Ƴɵ����Ͽ��Է����������ڣ��������Բ��� |
| B���ü�����ɵķ�ȩ��֬���γ���״�ṹ���������κ��ܼ� |
| C�����Ʊ�����ˮ����֬ʱҪ���뽻�������Եõ�������״�ṹ����֬ |
| D��ͨ��˵������ϳɲ�����ָ���ϡ��ϳ���ά���ϳ�ϴ�Ӽ� |
1989������������֯����ȷ��ΪʳƷ��ȾԴ֮һ�����Կ���ʹ�ã���������Ӧ��ʱӦ���Կ��Ƶ��ǣ�������
�������Ͻ� ���Ƶ��� ���ƴ��� ��������ˮ ���������մ���ʳƷ���ɼ� �������������������ӹ���θ��ƽҩƬ �������� ���װ�ǹ���СʳƷ��
�������Ͻ� ���Ƶ��� ���ƴ��� ��������ˮ ���������մ���ʳƷ���ɼ� �������������������ӹ���θ��ƽҩƬ �������� ���װ�ǹ���СʳƷ��
| A���ۢݢߢ� | B���ޢߢ� |
| C���ۢݢ� | D���ۢܢݢޢߢ� |
2011��3��15�ա�18�գ��й����ر�����������ʳ�Ρ�ʢ������ҥ�����Ե��η����䣬�ձ�������й©��Ⱦ���Σ������й���NaCl��˵���д�����ǣ�������
A��NaCl�ĵ���ʽ��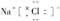 |
| B������ʱ����ʳ�β����ƻ�NaCl�еĻ�ѧ�� |
| C���ӵ�ʳ���мӵ���KIO3 |
| D��NaCl����ˮ�������룺NaCl=Na++Cl- |
����������ȷ���ǣ�������
| A��Fe��S��ϼ�������FeS2 |
| B��������ͭ��Ũ���ᷴӦ��һ���������� |
| C��NaHCO3�����ȶ��Դ���Na2CO3 |
| D�������ڿ����м��ȵ�һ���¶���ת��Ϊ���� |
 ����Ľṹʽ������ͼ��ʾ��������һ���������ܷ����ٺż���ڡ�ż���ͬʱ���ѣ�
����Ľṹʽ������ͼ��ʾ��������һ���������ܷ����ٺż���ڡ�ż���ͬʱ���ѣ�