题目内容
下列叙述正确的是( )
| A、不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半 |
| B、5.6 g铁与足量稀硫酸反应失去的电子的物质的量为0.3 mol |
| C、标准状况下,11.2L NO2气体中含氧原子数等于18 g水中含有的氧原子数 |
| D、20 g NaOH溶于1 L水,所得溶液中c(Na+)=0.5 mol/L |
考点:物质分子中的原子个数计算,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律,物质的量浓度和溶解度专题
分析:A.硫酸溶液密度大于1,所以等体积混合得到溶液浓度大于平均值;
B.铁与足量稀硫酸反应生成亚铁离子;
C.标准状况下,11.2L NO2气体中含氧原子数为
×2=1mol,18 g水中含有的氧原子数为
×1=1mol;
D.溶液的体积不是1L.
B.铁与足量稀硫酸反应生成亚铁离子;
C.标准状况下,11.2L NO2气体中含氧原子数为
| 11.2 |
| 22.4 |
| 18 |
| 18 |
D.溶液的体积不是1L.
解答:
解:A.硫酸溶液密度大于1,所以等体积混合得到溶液浓度大于平均值,不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度比原来的一半大,故A错误;
B.5.6 g铁与足量稀硫酸反应生成亚铁离子,失去的电子的物质的量为
×2=0.2 mol,故B错误;
C.标准状况下,11.2L NO2气体中含氧原子数为
×2=1mol,18 g水中含有的氧原子数为
×1=1mol,两者相等,故C正确;
D.20 g NaOH 溶于1 L水,溶液的体积不是1L,故D错误;
故选C.
B.5.6 g铁与足量稀硫酸反应生成亚铁离子,失去的电子的物质的量为
| 5.6 |
| 56 |
C.标准状况下,11.2L NO2气体中含氧原子数为
| 11.2 |
| 22.4 |
| 18 |
| 18 |
D.20 g NaOH 溶于1 L水,溶液的体积不是1L,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,难度中等.主要考查质量换算物质的量计算微粒数,气体摩尔体积的条件应用,溶液浓度与微粒的计算关系等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用.铝在下列应用时应加以控制的是( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶剂加工成胃舒平药片 ⑦易拉罐 ⑧包装糖果和小食品.
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶剂加工成胃舒平药片 ⑦易拉罐 ⑧包装糖果和小食品.
| A、③⑤⑦⑧ | B、⑥⑦⑧ |
| C、③⑤⑧ | D、③④⑤⑥⑦⑧ |
2011年3月15日~18日,中国各地爆发市民抢购食盐“盛况”,谣传“吃碘盐防辐射,日本大地震核泄漏污染海盐.”下列关于NaCl的说法中错误的是( )
A、NaCl的电子式是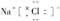 |
| B、炒菜时放入食盐并不破坏NaCl中的化学键 |
| C、加碘食盐中加的是KIO3 |
| D、NaCl溶于水发生电离:NaCl=Na++Cl- |
下列有机物命名正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
| B、HCOOCH(CH3)2 甲酸异丙酯 |
C、 |
D、 |
下列物质在一定条件下不能与SO2反应的是( )
| A、Na2CO3溶液 |
| B、Na2SO3溶液 |
| C、CaCl2溶液 |
| D、空气 |
最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体.18O是一种稳定的同位素,称为重氧.下列有关说法不正确的是( )
| A、1.8g 18O形成的气体的物质的量是0.05mol | ||
B、0.1mol重氧水H
| ||
| C、0.2mol 18O2气体的体积约为4.48L | ||
| D、18O2气体的摩尔质量为36g/mol | ||
| E、18O2气体的摩尔质量为36g/mol |
下列叙述正确的是( )
| A、Fe与S混合加热生成FeS2 |
| B、过量的铜与浓硝酸反应有一氧化氮生成 |
| C、NaHCO3的热稳定性大于Na2CO3 |
| D、白磷在空气中加热到一定温度能转化为红磷 |
下列每组物质的名称、俗名、化学式三者不能表示同一种物质的是( )
| A、甲烷、沼气、CH4 |
| B、氢氯酸、盐酸、HCl |
| C、氢氧化钠、火碱、NaOH |
| D、氧化钙、熟石灰、CaCO3 |