题目内容
17.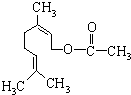 乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )
乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )①分子式为C11H18O2
②1mol该化合物水解最多消耗2mol NaOH
③1mol该化合物最多可与2mol H2反应
④化合物能发生的反应类型有:加成、取代、氧化、酯化
⑤该化合物有属于芳香族化合物的同分异构体.
| A. | ①②④ | B. | ③ | C. | ③⑤ | D. | ②③⑤ |
分析 有机物中含有碳碳双键,可发生加成、加聚和氧化反应,含有酯基,可发生水解反应,结合有机物的组成解答该题.
解答 解:①由结构简式可知分子中含有12个C原子,20个H原子,2个O原子,则分子式为C12H20O2,故错误;
②能与氢氧化钠反应的官能团只有酯基,水解生成羧基和羟基,只有羧基能与氢氧化钠反应,则1mol该有机物水解时只能消耗1mol NaOH,故错误;
③分子中含有2个碳碳双键,则1mol该有机物可消耗2mol H2,酯基与氢气不发生加成反应,故正确;
④含有碳碳双键,可法加成、氧化反应,含有酯基,可发生取代反应,不能发生酯化反应,故错误;
⑤分子中含有3个双键,则不饱和度为3,而酚类物质的不饱和度为4,则它的同分异构体中不可能属于芳香族化合物,故错误.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
5.A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物.在这些化合物中,A与B的原子个数比为A:B=1:2.已知A的原子序数为n,B的原子序数是①n+2 ②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是( )
| A. | ①④ | B. | ②⑧ | C. | ③⑤ | D. | ⑥⑦ |
2.在1.01×105Pa、120℃的条件下,某有机气体完全燃烧后恢复至原来的温度和压强,前后气体体积不发生变化,则该有机物可能是( )
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
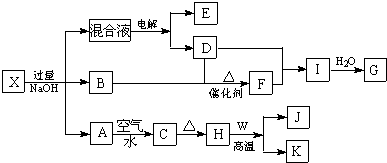
6.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质.由冰铜矿冶炼金属铜的流程如下:

已知各离子沉淀的范围如下表
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是升高温度或者增大浸取剂浓度等.
(2)溶液1的成分是NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是H2SiO3、Al(OH)3,
此时溶液中的溶质将变成NaHCO3.
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O,2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O.
(4)溶液2调节的pH范围为3.4≤pH<6.7.
(5>对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3.检验红褐色沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净.
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
当两极共产生标准状况下44.8L气体且阴阳两极产生的气体体积之比为1:1时,则析出的铜的质量为64g.

已知各离子沉淀的范围如下表
| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是升高温度或者增大浸取剂浓度等.
(2)溶液1的成分是NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是H2SiO3、Al(OH)3,
此时溶液中的溶质将变成NaHCO3.
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O,2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O.
(4)溶液2调节的pH范围为3.4≤pH<6.7.
(5>对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3.检验红褐色沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净.
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
当两极共产生标准状况下44.8L气体且阴阳两极产生的气体体积之比为1:1时,则析出的铜的质量为64g.
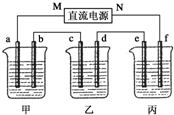 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.