题目内容
6.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质.由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是升高温度或者增大浸取剂浓度等.
(2)溶液1的成分是NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是H2SiO3、Al(OH)3,
此时溶液中的溶质将变成NaHCO3.
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O,2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O.
(4)溶液2调节的pH范围为3.4≤pH<6.7.
(5>对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3.检验红褐色沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净.
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
当两极共产生标准状况下44.8L气体且阴阳两极产生的气体体积之比为1:1时,则析出的铜的质量为64g.
分析 冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质,粉碎后得到冰铜矿矿粉,加入足量氢氧化钠溶液浸取,Al2O3和SiO2杂质溶液氢氧化钠生成NaAlO2和Na2SiO3,过滤得到溶液Ⅰ主要是NaAlO2和Na2SiO3,NaOH,沉淀Ⅰ为Cu2S、FeS,沉淀1加入H2O2和稀H2SO4后,得到溶液2中阴离子只有SO42-,金属阳离子有Cu2+ 和Fe3+,溶液2加入试剂调节溶液过滤得到氢氧化铁红褐色沉淀,溶液3主要是硫酸铜,电解硫酸铜溶液得到铜和硫酸,
(1)提高浸出率,的方法可以增大接触面积、升温、搅拌、增大浸取剂浓度等;
(2)上述分析可知溶液1的成分为偏铝酸钠、硅酸钠和氢氧化钠,若向其中通入足量的CO2可以析出的沉淀是硅酸和氢氧化铝沉淀,溶液中生成碳酸氢钠;
(3)沉淀1加入H2O2和稀H2SO4后,Cu2S、FeS溶解得到溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,据此书写离子方程式;
(4)溶液2调节的pH范围是沉淀铁离子,铜离子不能沉淀;
(5)检验红褐色沉淀是否洗净的方法是检验洗涤液中是否含硫酸根离子设计实验检验;
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液生成铜、氧气和硫酸,依据电极反应和电子守恒计算.
解答 解:冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质,粉碎后得到冰铜矿矿粉,加入足量氢氧化钠溶液浸取,Al2O3和SiO2杂质溶液氢氧化钠生成NaAlO2和Na2SiO3,过滤得到溶液Ⅰ主要是NaAlO2和Na2SiO3,NaOH,沉淀Ⅰ为Cu2S、FeS,沉淀1加入H2O2和稀H2SO4后,得到溶液2中阴离子只有SO42-,金属阳离子有Cu2+ 和Fe3+,溶液2加入试剂调节溶液过滤得到氢氧化铁红褐色沉淀,溶液3主要是硫酸铜,电解硫酸铜溶液得到铜和硫酸,
(1)提高浸出率,的方法可以增大接触面积、升温、搅拌、增大浸取剂浓度等,
故答案为:升高温度或者增大浸取剂浓度等;
(2)上述分析可知溶液1的成分为偏铝酸钠、硅酸钠和氢氧化钠,化学式为:NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是硅酸和氢氧化铝沉淀,H2SiO3、Al(OH)3,溶液中生成碳酸氢钠,
故答案为:NaAlO2、Na2SiO3、NaOH;H2SiO3、Al(OH)3;NaHCO3;
(3)沉淀1加入H2O2和稀H2SO4后,Cu2S、FeS溶解得到溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,反应的离子方程式:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O;2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O,
故答案为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O;2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O;
(4)溶液2调节的pH范围是沉淀铁离子,铜离子不能沉淀,溶液2调节的pH范围为3.4≤pH<6.7,
故答案为:3.4≤pH<6.7;
(5)检验红褐色沉淀是否洗净的方法是检验洗涤液中是否含硫酸根离子设计实验检验,检验红褐色沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净,
故答案为:取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净;
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液生成铜、氧气和硫酸,反应的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,依据电极反应和电子守恒计算,当两极共产生标准状况下44.8L气体物质的量=$\frac{44.8L}{22.4L/mol}$=2mol,且阴阳两极产生的气体体积之比为1:1时,每个电极生成气体物质的量为1mol,依据电子转移守恒计算,
阳极电极反应:4OH--4e-=2H2O+O2↑,
4 1
4mol 1mol
阴极电极反应:Cu2++2e-=Cu,
2 1
2mol 1mol
2H++2e-=H2↑
2 1
生成铜物质的量为1mol,质量=1mol×64g/mol=64g,
故答案为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;64g.
点评 本题考查了物质分离提纯方法、物质性质、电解原理和电子守恒的计算应用、离子检验等知识,掌握基础是解题关键,题目难度中等.

| A. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(OH-) | |
| C. | 10 mL0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
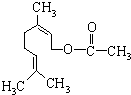 乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )
乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )①分子式为C11H18O2
②1mol该化合物水解最多消耗2mol NaOH
③1mol该化合物最多可与2mol H2反应
④化合物能发生的反应类型有:加成、取代、氧化、酯化
⑤该化合物有属于芳香族化合物的同分异构体.
| A. | ①②④ | B. | ③ | C. | ③⑤ | D. | ②③⑤ |
| A. | KOH的摩尔质量是56 g | |
| B. | 一个碳原子的质量就是其相对原子质量 | |
| C. | 硫原子的质量就是硫的相对原子质量 | |
| D. | 氦气的摩尔质量以g•mol-1为单位时在数值上等于它的相对原子质量 |
| A. | 0.lmol•L-lNaHC2O4溶液(pH=5.5):c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) | |
| B. | 0.lmol•L-1NaHS 溶液:C(OH-)+c(S2-)=c( H+)+c(H2S) | |
| C. | 0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c( OH-) | |
| D. | 0.lmol•L-lNH4HSO4 溶液中滴加 0.lmol•L-1NaOH 溶液至中性:c(Na+ )>c(SO42- )>c(NH4+ )>c(OH-)=c(H+) |
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
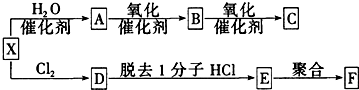
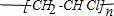 .
. 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
 ;D分子的空间构型为V型.
;D分子的空间构型为V型.