题目内容
7.有一晶体X,可发生如下的转化关系(部分反应物、生成物从略).其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热.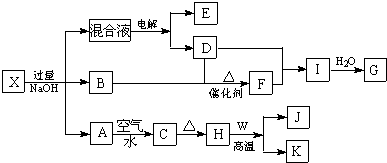
(1)I转化为G的反应中,当有2molG生成时,转移的电子数为2NA.
(2)A→C的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)对混合液电解时的阳极反应式为4OH--4e-=2H2O+O2↑.工业上金属W也可用电解法制备,电解时的阴极反应式为Al3++3e-=Al.
(4)将一定量的B和D放入容积为1L的密闭容器中,发生反应,在760~840℃下,反应达到平衡.该平衡常数的表达式为$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$.若平衡时两种反应物的转化率相等,则起始投料时n(B):n(D)=4:5.
(5)某恒温恒容密闭容器中,发生反应M(s)+2N(g)?P(g)+Q(g)
当下列物理量不再变化时,表明反应达到平衡的是ABD.
A.N的物质的量浓度 B.混合气体的平均相对分子质量
C.容器内的总压强 D.混合气体的密度
E. v正(N ):v逆(P)=1:2.
分析 C为难溶于水的红褐色固体,则C为Fe(OH)3,A为Fe(OH)2,X中含有亚铁离子,H为Fe2O3,W、K为常见的金属单质,H和W反应可放出大量的热,为铝热反应,则W为Al,K为Fe,J为Al2O3,B、D、E、F均为无色气体,F能和D反应生成I,可推知该过程是连续被氧化的过程,则D是O2,B是无色气体,且是X和碱反应生成的气体,能被氧气氧化,则B是NH3,F是NO,I为NO2,G为HNO3,E是气体,为电解时产生的气体,为H2,根据以上分析知,X中含有亚铁离子和铵根离子,在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,则X为(NH4)2Fe(SO4)2结合对应物质的性质以及题目要求解答该题.
解答 解:C为难溶于水的红褐色固体,则C为Fe(OH)3,A为Fe(OH)2,X中含有亚铁离子,H为Fe2O3,W、K为常见的金属单质,H和W反应可放出大量的热,为铝热反应,则W为Al,K为Fe,J为Al2O3,B、D、E、F均为无色气体,F能和D反应生成I,可推知该过程是连续被氧化的过程,则D是O2,B是无色气体,且是X和碱反应生成的气体,能被氧气氧化,则B是NH3,F是NO,I为NO2,G为HNO3,E是气体,为电解时产生的气体,为H2,根据以上分析知,X中含有亚铁离子和铵根离子,在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,则X为(NH4)2Fe(SO4)2结合对应物质的性质以及题目要求解答该题.
(1)I为NO2转化为G为HNO3的反应是,3NO2+H2O=2HNO3+NO,当有2mol HNO3生成时,转移的电子数为2NA;
故答案为:2NA;
(2)A→C的化学反应是氢氧化亚铁被氧气氧化生成氢氧化铁的反应,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)分析反应可知,混合溶液为NaOH、Na2SO4溶液,对混合液电解时的阳极反应式为溶液中氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑;工业上金属W为Al可用电解熔融氧化铝制备,电解时的阴极反应式为:Al3++3e-=Al;
故答案为:4OH--4e-=2H2O+O2↑;Al3++3e-=Al;
(4)将一定量的B和D放入容积为1L的密闭容器中,发生反应为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
该反应的平衡常数表达式为:K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$,若平衡时两种反应物的转化率相等,消耗量为4:5,则起始投料时n(NH3):n(O2)=4:5;
故答案为:$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$;4:5;
(5)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,
某恒温恒容密闭容器中,发生反应M(s)+2N(g)?P(g)+Q(g),
A.N的物质的量浓度不变是平衡标志,故A正确;
B.M为固体,反应前后气体质量变化,气体物质的量不变,当混合气体的平均相对分子质量不变说明反应达到平衡状态,故B正确;
C.反应前后气体物质的量不变,容器内的总压强始终不变,不能说明反应达到平衡状态,故C错误;
D.反应前后气体质量变化,体积不变,当混合气体的密度不变说明反应达到平衡状态,故D正确;
E.速率之比等于化学方程式计量数之比为正反应速率之比,当 v正(N ):v逆(P)=2:1.说明P正逆反应速率相同反应达到平衡状态,v正(N ):v逆(P)=1:2不能说明反应达到平衡状态,故E错误;
故答案为:ABD.
点评 本题考查了物质转化关系分析推断,物质性质和反应现象分析判断应用,掌握物质性质和特征反应是解题关键,题目难度中等.

| A. | 过氧化氢中既含有极性键又含有非极性键 | |
| B. | 18O原子中含有18个中子 | |
| C. | 含有相同电子数的H2O和NH3的分子数相同 | |
| D. | 苯分子中所有原子共处在同一平面上 |
| A. | Na+、K+、AlO2-、CO32- | B. | Ag+、Cu2+、NO3-、Cl- | ||
| C. | Mg2+、Fe3+、Cl-、SO42- | D. | NH4+、K+、SO42-、CO32- |
| A. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(OH-) | |
| C. | 10 mL0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |

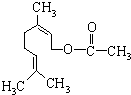 乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )
乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )