题目内容
14.在下列实验中,实验操作与现象一致的是( )| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸铜溶液中加入具有钠反应生成氢氧化铜、硫酸钠和氢气;
B.过氧化氢具有氧化性,可以氧化亚铁离子为铁离子,溶液颜色发生变化;
C.过氧化钠具有强氧化性,可与水反应生成氢氧化钠和氧气,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+;
D.将氢氧化钠溶液逐滴滴入氯化亚铁溶液中反应生成白色沉淀氢氧化亚铁,在空气中迅速变化为灰绿色,最后变化为红褐色;
解答 解:A.硫酸铜溶液中加入钠反应生成氢氧化铜、硫酸钠和氢气,离子方程式:Cu2++2Na+2H2O=Cu(OH)2↓+2Na++H2↑,无红色铜生成,故A错误;
B.过氧化氢具有氧化性,可以氧化亚铁离子为铁离子,溶液浅绿色变化为黄色,故B错误;
C.将Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,Fe3+与氢氧化钠反应,3OH-+Fe3+=Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,故C正确;
D.将氢氧化钠溶液逐滴滴入氯化亚铁溶液中反应生成白色沉淀氢氧化亚铁,在空气中迅速变化为灰绿色,最后变化为红褐色,溶液中不能立即生成红褐色沉淀,故D错误;
故选C.
点评 本题考查了物质性质的实验验证方法和反应现象的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
4.下列过程中,共价键被破坏的是( )
| A. | HCl气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | 碘升华 |
2.下列说法正确的是( )
| A. | 一种金属元素和一种非金属元素一定能形成离子化合物 | |
| B. | 离子键只存在于离子化合物中 | |
| C. | 共价键只存在于共价化合物中 | |
| D. | 离子化合物中必定含有金属元素 |
9.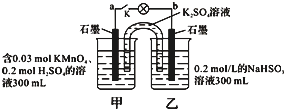 如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
 如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a | |
| C. | 电池工作时,甲烧杯发生的反应为MnO4-+3e-+4H+═MnO2+2H2O | |
| D. | 乙池中的氧化产物为SO42- |
19.下列物质中可用来鉴别乙酸、乙醇、苯的是( )
| A. | 水 | B. | 溴水 | C. | 酚酞溶液 | D. | 石蕊溶液 |
6.下列有关叙述中正确的是( )
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是元素原子核外电子排步周期性变化的必然结果 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
3.下列叙述中,正确的是( )
| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
4.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:H2O>H2S | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H3PO4>H2SO4 | D. | 还原性:I->Cl- |
 ;写出结构式:CO2O=C=O.
;写出结构式:CO2O=C=O.