题目内容
18.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )| A. | Na2O2只作氧化剂 | |
| B. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | 每生成16g氧气就有1mol Fe2+ 被还原 | |
| D. | Na2FeO4既是还原产物又是氧化产物 |
分析 该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,据此分析解答.
解答 解:A.根据以上分析,该反应中过氧化钠既作氧化剂又作还原剂,故A错误;
B.反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故B错误;
C.该反应中Fe元素化合价由+2价变为+6价,根据2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成16g氧气就有1mol Fe2+ 被氧化,故C错误;
D.该反应中Fe元素化合价由+3价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,Na2FeO4既是氧化产物又是还原产物,故D正确;
故选D.
点评 本题考查氧化还原反应,侧重考查基本概念、计算,明确元素化合价变化是解本题关键,注意过氧化钠的作用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列各組离子在指定的溶液中一定能大量共存的是( )
| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合后所含的分子数小于0.75NA | |
| C. | 常温下,1L PH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA | |
| D. | 在100mL 1 mol•L-5 Na2S02溶液与1.12 L(标准状况)CL2的反应中,•还原剂失电子0.2NA |
13.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
| A. |  氢氧化钠溶液 | B. |  淀粉碘化钾溶液 | C. |  氢氧化钠溶液 | D. |  淀粉碘化钾溶液 |
3.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图1所示:

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
(1)加入NaOH溶液主要为了除去Mg2+(填离子符号),发生反应的离子方程式为MgCO3+2OH-=Mg(OH )2↓+CO32-;“沉淀”的主要成份有Mg(OH)2、Fe(OH)3、CaCO3(填化学式); 向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
10.下列对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色无味的可使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加入稀盐酸,沉淀不消失,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入碳酸钠溶液产生白色沉淀,再加入盐酸,白色沉淀消失,则原溶液中一定含有Ba2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
7.一种新型净水剂PAFC(聚合氯化铁铝,化学式可表示为[AlFe(OH)nCl6-n]m,n<5,m<10),广泛用于生活用水的净化和废水的净化.下列有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,比用相同量的氯化铝或氯化铁对水的pH改变大 | |
| B. | PAFC中铁为+2价 | |
| C. | PAFC可看作一定比例的氯化铝和氯化铁的水解产物 | |
| D. | PAFC在强酸性或强碱性溶液中都能稳定存在 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
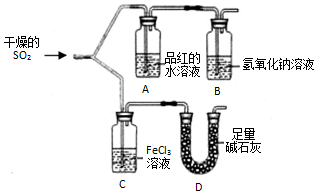 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.