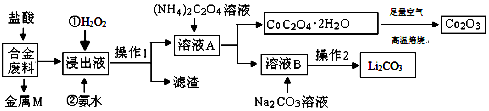
题目内容
6.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述正确的是( )| A. | 电池放电时正极上有气泡产生 | B. | 电池放电时Cl-由负极向正极迁移 | ||
| C. | 正极反应式为Ag++e-=Ag | D. | 负极副反应为Mg+H2O=Mg(OH)2+H2↑ |
分析 Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,正极反应为:2AgCl+2e-═2C1-+2Ag,负极反应式为:Mg-2e-=Mg2+,据此分析.
解答 解:A.AgCl是氧化剂,AgCl在正极上得电子,则正极电极反应式为:2AgCl+2e-═2C1-+2Ag,所以正极上没有气泡生成,故A错误;
B.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故B错误;
C.AgCl是难溶物,其电极反应式为:2AgCl+2e-═2C1-+2Ag,故C错误;
D.镁是活泼金属与水反应,即负极副反应为Mg+2H2O=Mg(OH)2+H2↑,故D正确;
故选:D.
点评 本题考查原电池原理,注意把握正负极的判断以及电极反应式的书写,正确判断化合价的变化为解答该题的关键,题目难度中等.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
16.以共用电子对形成分子的化合物叫做共价化合物.下列物质属于共价化合物的是( )
| A. | H2 | B. | CO2 | C. | CaCl2 | D. | NaOH |
17.“纳米材料”是当今材料科学研究的前沿,其研究成果广泛用于催化剂及军事科学中.所谓“纳米材料”是指研究、开发出的直径从几纳米到几十纳米的材料.如将纳米材料分散到分散剂中,所得混合物可能具有的性质是(1nm=10-9m)( )
| A. | 能全部透过半透膜 | B. | 没有丁达尔现象 | ||
| C. | 所得液体透过滤纸 | D. | 所得物质一定是浊液 |
1.据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,有关键能数据如下表:
已知1molSi中含2molSi-Si键,1molSiO2中含4molSi-O键,则x的值为460.
(2)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是D.
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,可以使反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
(3)工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJ•mol-1,生成的HCl通入100mL 1mol•L-1的NaOH溶液恰好完全被吸收,则上述制备纯硅的反应过程中吸收(填“吸收”或“释放”)的热量为6.01kJ.
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,有关键能数据如下表:
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | x | 498.8 | 176 |
(2)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是D.
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,可以使反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
(3)工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJ•mol-1,生成的HCl通入100mL 1mol•L-1的NaOH溶液恰好完全被吸收,则上述制备纯硅的反应过程中吸收(填“吸收”或“释放”)的热量为6.01kJ.
18.化学与生活密切相关.下列有关说法正确的是( )
| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
7. 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
(1)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积2.24L.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
②取一定体积CO和H2的混合气体(物质的量之比为1:2),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0 (填“>”、“<”或“=”).
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”、“<”或“=”).
④若容器容积不变,下列措施可增加甲醇产率的是BD
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤经测定不同温度下该反应的平衡常数如表:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol/L、c(H2)=0.4mol/L、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填>、<或=).
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为O2+4e-=2O2-.电池工作时,固体电解质里的O2-向负极移动.
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积2.24L.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
②取一定体积CO和H2的混合气体(物质的量之比为1:2),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0 (填“>”、“<”或“=”).
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”、“<”或“=”).
④若容器容积不变,下列措施可增加甲醇产率的是BD
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤经测定不同温度下该反应的平衡常数如表:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为O2+4e-=2O2-.电池工作时,固体电解质里的O2-向负极移动.
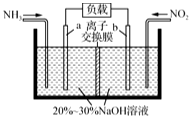 利用所学化学知识解答下列问题:
利用所学化学知识解答下列问题: