题目内容
18.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).(1)反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ.mol-1.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与过氧化氢反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物无污染.
(4)汽油的重要成分是辛烷(C8H8),1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量.请写出此反应的热化学方程式C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H==-5518kJ•mol-1.
(5)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中放出的热量为173.4kJ.
分析 (1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol,依据盖斯定律计算;
(3)其产物无毒无污染;
(4)1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量,则辛烷的燃烧热是5518kJ/mol;
(5)$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,根据甲烷和反应热之间的关系式计算.
解答 解:(1)解:反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为$\frac{256.7kJ}{0.4mol}$=641.75kJ,
所以反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75kJ/mol:则16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol;与液态双氧水反应生成液态水时放出的热量408.875kJ,
故答案为:408.875;
(3)其产物无毒无污染,不影响环境,故答案为:产物无污染;
(4)1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量,则辛烷的燃烧热是5518kJ/mol,其热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H==-5518 kJ•mol-1,
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H==-5518 kJ•mol-1;
(5)$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,标准状况下4.48LCH4其物质的量为0.2mol,则放出的热量为0.2mol×867kJ=173.4kJ,
故答案为:173.4.
点评 本题考查反应热的有关计算,为高频考点,侧重考查学生分析计算能力,明确盖斯定律的灵活运用、正确书写目标方程式是解本题关键,题目难度中等.

| A. | 用酸性高锰酸钾溶液鉴别直馏汽油与裂化汽油 | |
| B. | 用溴水鉴别苯、甲苯 | |
| C. | 用燃烧方法鉴别聚乙烯、聚氯乙烯 | |
| D. | 用溴水鉴别苯、硝基苯和苯乙烯 |
| A. | 原子半径:ra>rb>rc | B. | 微粒半径:Bn->An+ | ||
| C. | C元素不一定是稀有气体元素 | D. | 原子序数:C>B>A |
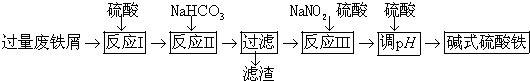
已知:部分阳离子以氢氧化物形式沉淀时溶剂的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaHCO3调节体系PH在4.4≤pH<7.5 范围内.
(3)反应Ⅲ中生成的气体遇空气变红棕色,则反应Ⅲ中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的PH,若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$聚合离子,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
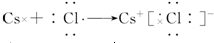 .
.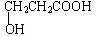 ;若甲能发生银镜反应,则甲的结构简式为
;若甲能发生银镜反应,则甲的结构简式为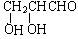 .
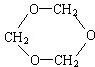
.
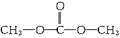 .
.