题目内容
10.某稀溶液含下列离子中的4种,且各种离子的物质的量均为0.01mol阳离子 K+、Ba2+、Fe2+、Al3+、Fe3+
阴离子 OH-、CO32-、Cl-、NO3-、SO42-
若向原溶液中加入足量的盐酸,只有一种气体生成,且在空气中会迅速变为红棕色.向原溶液中加入Ba(NO3)2后产生沉淀,过滤,加入HNO3酸化的AgNO3后无白色沉淀生成.
(1)溶液中一定不 (填“一定”,“一定不”,“可能”)含有CO32-,理由是根据后续现象,已经确定有Fe2+,而Fe2+与CO32-不能大量共存(或向原溶液中加入盐酸只产生一种气体NO,没有CO2,所以没有CO32-)
(2)将溶液进行焰色反应看到的现象是透过蓝色钻玻璃观察,火焰为紫色
(3)写出生成的气体在空气中迅速变为红棕色的化学方程式2NO+O2═2NO2
(4)原溶液中阴离子为NO3-、SO42-,阳离子为K+、Fe2+
(5)向原溶液中加入足量的盐酸,有无色气体生成的离子方程式为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
分析 向溶液中加入足量的盐酸,只有一种气体生成,且在空气中会迅速变为红棕色,说明产生气体为NO,没有CO32-,原溶液中一定存在Fe2+、NO3-,酸性环境下生成的一氧化氮;向原溶液中加入Ba(NO3)2后产生沉淀,过滤,加入HNO3酸化的AgNO3后无白色沉淀生成,则有SO42-,无Cl-;若只含有SO42-和NO3-,Fe2+,三者的物质的量均为0.01mol,而溶液中含有4种离子,则不满足电荷守恒,所以还含有钾离子,所以含有的4种离子为:NO3-、SO42-;Fe2+、K+,根据以上分析进行解答各题.
解答 解:向溶液中加入足量的盐酸,只有一种气体生成,且在空气中会迅速变为红棕色,说明产生气体为NO,没有CO32-,原溶液中一定存在Fe2+、NO3-,酸性环境下生成的一氧化氮;向原溶液中加入Ba(NO3)2后产生沉淀,过滤,加入HNO3酸化的AgNO3后无白色沉淀生成,则有SO42-,无Cl-;若只含有SO42-和NO3-,Fe2+,三者的物质的量均为0.01mol,而溶液中含有4种离子,则不满足电荷守恒,所以还含有钾离子,含有的4种离子为:NO3-、SO42-;Fe2+、K+,
(1)根据以上分析可知,溶液中一定不存在CO32-,原因为根据后续现象,已经确定有Fe2+,而Fe2+与CO32-不能大量共存(或向原溶液中加入盐酸只产生一种气体NO,没有CO2,所以没有CO32-),
故答案为:一定不;根据后续现象,已经确定有Fe2+,而Fe2+与CO32-不能大量共存(或向原溶液中加入盐酸只产生一种气体NO,没有CO2,所以没有CO32-);
(2)根据上述分析,溶液中一定含有钾离子,故焰色反应看到的现象是透过蓝色钻玻璃观察,火焰为紫色,
故答案为:透过蓝色钻玻璃观察,火焰为紫色;
(3)NO遇到氧气迅速反应生成红棕色的二氧化氮,反应为2NO+O2═2NO2,
故答案为:2NO+O2═2NO2;
(4)根据分析可知,溶液中一定存在的阴离子为:NO3-、SO42-;一定存在的阳离子为:K+、Fe2+,
故答案为:NO3-、SO42-;K+、Fe2+;
(5)向原溶液中加入足量的盐酸,有无色气体为一氧化氮,反应离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
点评 本题考查了离子性质的应用和实验方案的推断和分析判断,为高频考点,注意把握离子共存和离子变化特征,元素守恒和溶液中电荷守恒的计算应用是判断的关键,题目难度中等.

| A. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| B. | 实验室从海带提取碘单质的步骤是:取样、灼烧、溶解、过滤、萃取 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 中和滴定实验中,如用于盛放待测液的锥形瓶洗净后未经干燥,不影响测定结果 |
| A. | 3s23p3 | B. | 3s23p5 | C. | 3s23p4 | D. | 3s23p6 |
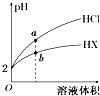 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | a、b两点:c(X-)>c(Cl-) | B. | 稀释10倍,HX溶液的pH=3 | ||
| C. | 稀释前,c(HX)=0.01 mol•L-1 | D. | 溶液的导电性:a>b |
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 四种元素的单质中,Z单质的熔沸点最高 | |
| D. | X的单质能与H2反应,生成一种弱酸性的物质 |
| A. | 三种物质质子数之比为1:2:3 | B. | 三种物质中子数之比为1:1:1 | ||
| C. | 三种物质的摩尔质量之比为8:9:10 | D. | 三种物质的化学性质不同 |
| 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中,第一电离能最小的是②(填编号);
(2)元素⑨和⑩形成的化合物的化学式为Si3N4;元素⑦的原子价电子排布式是3s23p5;
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是π键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是SO2(填分子式);
(4)根据对角线规则,Be与元素④的最高价氧化物的水化物的性质相似,它们都具有两性,显示这种性质的离子方程式是Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
(5)由以上某些元素形成的有机物苯酚(
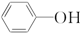 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子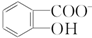 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化. | A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙炔在氧气中燃烧;乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 工业上由乙烯和水反应生成乙醇;由苯与液溴反应生成溴苯 | |
| D. | 由乙烯制取聚乙烯;由苯制取硝基苯 |