题目内容
18.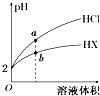 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | a、b两点:c(X-)>c(Cl-) | B. | 稀释10倍,HX溶液的pH=3 | ||
| C. | 稀释前,c(HX)=0.01 mol•L-1 | D. | 溶液的导电性:a>b |
分析 根据盐酸是强酸,完全电离,加水稀释相同的倍数,HX溶液的pH变化小,则HX在溶液中存在部分电离,所以HX为弱酸,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,以此解答该题.
解答 解:A.盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,所以a、b两点:c(X-)>c(Cl-),故A正确;
B.HX为弱酸,溶液稀释时,HX进一步电离,pH=2的HX,稀释10倍,HX溶液的pH<3,故B错误;
C.HX为弱酸,pH=2时,c(HX)>0.01 mol/L,故C错误;
D.盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,溶液的导电性:a<b,故D错误;
故选A.
点评 本题考查强弱电解质溶液稀释时的pH、浓度变化,侧重于学生的分析能力和对基础知识的应用能力的考查,注意加水促进弱电解质电离的特点,难度不大.

练习册系列答案
相关题目
13.下列有关离子键和离子化合物的说法正确的是( )
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 在化合物MgCl2中,两个氯离子之间也存在离子键 | |
| C. | 离子化合物中不可能有共价键 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
3.元素的性质随原子序数的递增呈周期性变化的原因是( )
| A. | 元素原子的电子层数呈周期性变化 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |



 .
.