题目内容
1.在下面的电子结构中,第一电离能最小的原子可能是( )| A. | 3s23p3 | B. | 3s23p5 | C. | 3s23p4 | D. | 3s23p6 |
分析 同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,同一主族元素中,其第一电离能随着原子序数的增大而减小.
解答 解:同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,同一主族元素中,其第一电离能随着原子序数的增大而减小,3s23p3属于第VA族元素、3s23p5属于第VIIA族元素、3s23p4属于第VIA族元素、3s23p6属于O族元素,这几种元素都是第三周期元素,分别是P、Cl、S、Ar,其第一电离能大小顺序是Ar>Cl>P>S,所以第一电离能最小的原子是S,
故选:C.
点评 本题考查了第一电离能大小的判断,明确元素周期律中第一电离能变化规律是解本题关键,再根据元素在周期表中所处位置判断,题目难度不大.

练习册系列答案
相关题目
12.在通常情况下,下列各组物质的性质排列不正确的是( )
| A. | 沸点:己烷>2-甲基丁烷>戊烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2-四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
16.根据下表中有关短周期元素性质的数据,下列说法不正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第3周期ⅤA族 | |
| C. | 元素①与元素⑥形成的化合物中不可能存在共价键 | |
| D. | 元素⑧对应的最高价氧化物及其水化物都具有两性 |
13.下列有关离子键和离子化合物的说法正确的是( )
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 在化合物MgCl2中,两个氯离子之间也存在离子键 | |
| C. | 离子化合物中不可能有共价键 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
11.下列判断错误的是( )
| A. | 沸点:NH3>PH3>AsH3 | B. | 稳定性:HF>HCl>HBr>HI | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
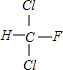 ;
;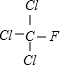 +HCl,生成氟氯昂可表示为F-11.
+HCl,生成氟氯昂可表示为F-11.