题目内容
16.检验氯化氢气体中是否混有氯气,不可采用的方法是( )| A. | 用湿润的有色布条 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 将气体通入硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |
分析 氯气与水反应生成的HClO,具有漂白性,氯气能氧化碘离子生成碘单质,氯离子与硝酸银反应生成白色沉淀,以此来解答.
解答 解:A.若湿润的有色布条褪色,则氯化氢气体中混有氯气,故A不选;
B.若湿润的蓝色石蕊试纸褪色,则氯化氢气体中混有氯气,故B不选;
C.无论是否混有氯气,将气体通入硝酸银溶液均生成AgCl白色沉淀,不能检验,故C选;
D.若湿润的淀粉碘化钾试纸变蓝,则氯化氢气体中混有氯气,故D不选;
故选C.
点评 本题考查物质的鉴别及氯气的性质,为高频考点,把握HClO的漂白性及氯气的强氧化性为解答的关键,注意利用性质的差异检验物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质不能由单质直接化合生成的是( )
| A. | FeCl2 | B. | Na2O | C. | SO2 | D. | NO |
1.相同温度下,体积均为0.50L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
8.下列各化合物中,能发生酯化、加成、消去三种反应的是( )
| A. | CH3-CH═CH-CHO | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
6.在密闭容器中,加入一定量的A、B混合气体,发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0,40mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的产率不变 |
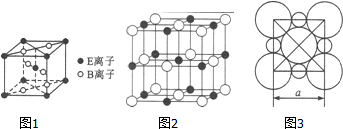 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: .
.