题目内容
6.已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Ma2CO3)>pH(CH3COONa) | |
| B. | amol/L HCN 溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则一定a大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离(程)度、c(H+)均先增大后减小 | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
分析 A.酸的电离常数越大,酸的酸性越强,其盐的水解程度越小;
B.当 HCN 与NaOH等物质的量反应时,生成NaCN,NaCN溶液中c(Na+)>c(CN-);
C.冰醋酸中逐滴加水,醋酸的电离程度增大;
D.根据电荷守恒分析.
解答 解:A.酸的电离常数越大,酸的酸性越强,其盐的水解程度越小,其溶液的pH越小,酸性:CH3COOH>HCN>CO3-,所以其盐的水解程度:Na2CO3>NaCN>CH3COOH,则等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B.当 HCN 与NaOH等物质的量反应时,生成NaCN,NaCN溶液中c(Na+)>c(CN-),所以a不一定大于b,故B错误;
C.冰醋酸中逐滴加水,醋酸的电离程度增大,溶液的导电性、c(H+)均先增大后减小,故C错误;
D.NaHCO3和Na2CO3的混合溶液中,一定存在电荷守恒,即:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确.
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,反应后溶质的量及电离、水解的大小,结合电荷守恒和物料守恒解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.实验是化学研究的基础,关于各实验装置图的叙述中,正确的是( )

| A. | 装置①可用干石油的分馏 | |
| B. | 装置②可用于酒精提取溴水中的Br2 | |
| C. | 装置③可用于吸收HCl气体,并能防止倒吸 | |
| D. | 装置④验证乙烯的生成 |
1.在恒温恒容密闭容器中发生反应2NO2?2NO+O2,不能说明反应达到平衡状态的是( )
| A. | 2v(O2)=v(NO2) | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO2 | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均相对分子质量不再改变 |
11.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 电池中的重金属等污染土壤,可以回收再利用以减少污染、保护资源 | |
| C. | 人们日常生活中用到各种化学品,应尽量减少甚至不使用 | |
| D. | 城市机动车成为PM2.5(直径≤2.5微米的颗粒物,也称为可入肺颗粒物,有毒、有害)主要源头,必须加以控制 |
18.如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法一定正确的是( )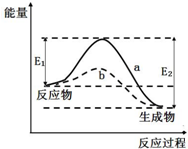

| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
15.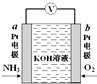 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 负极的电极反应式为:2NH3-6e-+6OH-═N2↑+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |

 .
.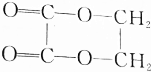 的化学方程式(无机试剂任选)并注明反应类型.
的化学方程式(无机试剂任选)并注明反应类型. (取代反应).
(取代反应).