题目内容
13.下列各组离子能在指定溶液中大量共存的是( )| A. | pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| B. | 室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Al3+、NO3-、I- | |
| D. | 无色溶液中:Al3+、NH4+、Cl?、HCO3? |
分析 A.pH=14的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.室温下水电离的c(H+)=10-13mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子和氢氧根离子;
C.室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子、碘离子;
D.铝离子与碳酸氢根离子发生双水解反应.
解答 解:A.pH=14的溶液为碱性溶液,CO32-、Na+、S2-、AlO2-之间不反应,都不与碱性溶液中的氢氧根离子反应,故A正确;
B.室温下水电离的c(H+)=10-13mol/L的溶液为酸性或碱性溶液,HCO3-与氢离子和氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液为酸性溶液,NO3-在酸性条件下具有氧化性,能够氧化Fe2+、I-,在溶液中不能大量共存,故C错误;
D.Al3+、HCO3?之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
相关题目
3.下列物质中,属于电解质的是( )
| A. | 铁 | B. | 氢氧化钾 | C. | 酒精 | D. | 空气 |
4.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 235 g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子( ${\;}_{0}^{1}$n)数为10NA | |
| B. | 60 g丙醇中存在的共价键总数为10 NA | |
| C. | 25 g质盆分数为68%的H202的水溶液中含氧原子数为NA | |
| D. | 2.0 g H218O与D2O的混合物中所含中子数为NA |
1.在恒温恒容密闭容器中发生反应2NO2?2NO+O2,不能说明反应达到平衡状态的是( )
| A. | 2v(O2)=v(NO2) | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO2 | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均相对分子质量不再改变 |
8.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)请根据上述信息判断下列反应不能发生的是BD(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.18mol•L-1的AgNO3溶液中加入相同体积0.22mol•L-1的盐酸,则c(Ag+)=9.0×10-8mol/L.
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.18mol•L-1的AgNO3溶液中加入相同体积0.22mol•L-1的盐酸,则c(Ag+)=9.0×10-8mol/L.
18.如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法一定正确的是( )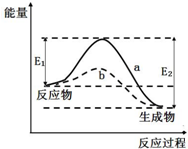

| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
2.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有4位同学为鉴别它们采用了以下不同的方法,其中不可行的是( )
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别取固体样品,滴加同浓度盐酸,观察产生气泡的快慢 |
1.下列四种化学操作名称从左到右分别是( )
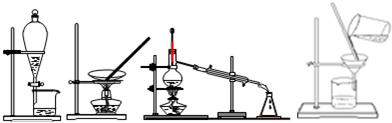

| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: