题目内容
某温度下一定体积的密闭容器中发生如下反应:2A(g)+B(g)?2C(g),若开始时充入2mol A和2molB,达到平衡时,A的体积分数为w;若在相同条件下充入下列起始物料,则达到平衡时A体积分数小于w的是( )
| A、1mol A和1molB |
| B、2molC |
| C、3mol A和3molB |
| D、1molB和2molC |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:反应2A(g)+B(g)?2C(g)中,正反应气体体积减小,开始时充入2mol A和2molB,达到平衡时,A的体积分数为w,若要使A体积分数小于w,只要使平衡正向移动即可,物质全部转化为A、B,总物质的量比原来大,再结合浓度对平衡移动的影响进行判断.
解答:
解:A、加入1mol A和1molB,相对于原平衡,相当于将原容器体积增大一倍,平衡逆向移动,A的体积分数增大,故A不选;
B、加入2molC,相当于加入2molA和1molB,相对于原平衡,相当于减小了1molB,平衡逆向移动,A的体积分数增大,故B不选;
C、加入3mol A和3molB,相对于原平衡,相当于减小容器体积,平衡正向移动,A的体积分数减小,故C选;
D、加入1molB和2molC,相当于加入2molA和 2molB,与原平衡相同,A的体积分数不变,故D不选;
故选C.
B、加入2molC,相当于加入2molA和1molB,相对于原平衡,相当于减小了1molB,平衡逆向移动,A的体积分数增大,故B不选;
C、加入3mol A和3molB,相对于原平衡,相当于减小容器体积,平衡正向移动,A的体积分数减小,故C选;
D、加入1molB和2molC,相当于加入2molA和 2molB,与原平衡相同,A的体积分数不变,故D不选;
故选C.
点评:本题考查平衡移动问题,题目难度中等,本题注意极端假设法的应用,再结合浓度对平衡移动的影响可进行判断.

练习册系列答案
相关题目
1953年日本水俣湾发生了一起重大的中毒事件,造成人畜大量死亡.科学家分析发现,水俣湾鱼体内甲基汞的含量比周围水体内的甲基汞含量高3000倍,那么甲基汞进入鱼体内的主要方式是 ( )
| A、主动运输 |
| B、渗透作用 |
| C、鳃部交换气体随血液循环 |
| D、水中食物链 |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中(如图 1),使其发生反应,t0时容器Ⅰ中达到化学平衡,X(g)、Y(g)、Z(g)的物质的量的变化如图2所示.则下列有关推断正确的是( )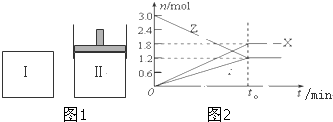

| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
对室温下等pH、等体积的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、加入足量的苏打固体充分反应后,两溶液中产生的CO2一样多 |
| C、加水稀释2倍后,两溶液的pH均减小 |
| D、加足量的锌充分反应后,盐酸中产生的氢气速率快 |


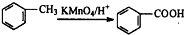
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.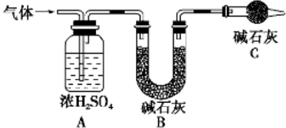 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物