题目内容
5.某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O).
请回答:
(1)写出步骤Ⅱ反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪有烧杯、玻璃棒、漏斗.
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是由装置a制取的CO2中含HCl气体,通入溶液A中会溶解Al(OH)3.
(4)从溶液E得到绿矾晶体的实验操作是蒸发浓缩、冷却结晶过滤.
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径③中反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,用途径 ①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为3:2.
分析 铝、铁和铜的合金中只有金属铝可以和氢氧化钠反应,过滤后,得到溶液A含有NaAlO2,固体B为Cu和Fe.溶液A中通入过量的二氧化碳可以得到氢氧化铝沉淀与碳酸氢钠,过滤分离,得到C为Al(OH)3,D为NaHCO3溶液,固体B用试剂X反应,过滤分离得到溶液E,溶液E蒸发浓缩、冷却结晶可以获得绿矾晶体,可知试剂X为稀硫酸,E为FeSO4,F为Cu,Cu转化得到硫酸铜,CuSO4溶液蒸发浓缩、冷却结晶可以获得胆矾晶体,
(1)步骤Ⅱ中偏铝酸钠与二氧化碳反应生成Al(OH)3与NaHCO3;
(2)由上述分析可知,步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,都用到过滤操作,过滤用到的玻璃仪有烧杯、玻璃棒、漏斗;
(3)盐酸具有挥发性,挥发出的HCl导致氢氧化铝溶解;
(4)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作;
(5)途径③中Cu与浓硫酸反应生成 硫酸铜、二氧化硫与水;途径①中Cu与混酸反应生成铜盐、NO与水,反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据反应的离子方程式可计算出混酸中硫酸和硝酸的最佳物质的量之比.
解答 解:(1)步骤Ⅱ中偏铝酸钠与二氧化碳反应生成Al(OH)3与NaHCO3,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)由上述分析可知,步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,都用到过滤操作,过滤用到的玻璃仪有烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(3)盐酸具有挥发性,由装置a制取的CO2中含HCl气体,通入溶液A中会溶解Al(OH)3,
故答案为:由装置a制取的CO2中含HCl气体,通入溶液A中会溶解Al(OH)3;
(4)从硫酸铜溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,
故答案为:蒸发浓缩、冷却结晶;
(5)途径③中Cu与浓硫酸反应生成 硫酸铜、二氧化硫与水,反应化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
途径①中Cu与混酸反应生成铜盐、NO与水,反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据反应的离子方程式可知,硝酸根与氢离子的物质的量之比为2:8=1:4,所以混酸中硫酸和硝酸的最佳物质的量之比3:2,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;3:2.
点评 本题考查实验制备方案、物质的分离和提纯、对方案的分析评价等,关键是理解工艺流程原理,是对学生综合能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 氯最高价氧化物对应的水化物为HClO4;则氟最高价氧化物对应的水化物HFO4 | |
| D. | NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性 |
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
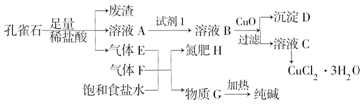
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中.其中,应先通入的气体是F、NH3(填代号及对应物质的化学式).
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要由金属元素和非金属元素形成的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8个电子的稳定结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |
| A. | 铜和FeCl3溶液均能导电,但二者都不是电解质 | |
| B. | 分解反应的生成物中一定有单质 | |
| C. | 分散质粒子的直径在1×10-9~1×10-7cm之间的分散系属于胶体 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
| A. | Ca2+、K+、HCO3-、Cl- | B. | Fe3+、K+、SO42-、I- | ||
| C. | NH4+、Na+、CO32-、NO3- | D. | Cu2+、Na+、SO42-、Cl- |