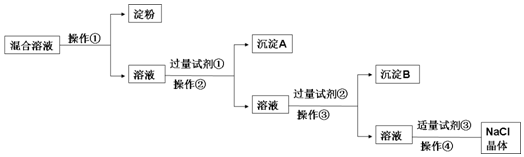
题目内容
20.下列物质中,只含有离子键的是( )| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.含离子键和O-O非极性共价键,故A不选;
B.含离子键和O-H极性共价键,故B不选;
C.只含离子键,故C选;
D.只含共价键,故D不选;
故选C.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意选项C中不存在共价键,题目难度不大.

练习册系列答案
相关题目
20.下列分子或离子的中心原子杂化轨道的类型相同的是( )
| A. | SO32-与SO3 | B. | CH4与H2O | C. | NCl3与BF3 | D. | SO32-与CO32- |
8.下列根据实验现象所得出的结论中,正确的是( )
| A. | 向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- | |
| B. | 向无色溶液加入盐酸有气体产生,结论:溶液中有CO32- | |
| C. | 向无色试液加入硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- | |
| D. | 向某溶液中加入氢氧化钠溶液加热,有氨气生成,结论:溶液中含有NH4+ |
12.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol |

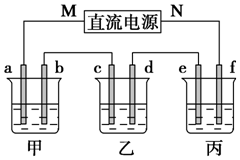 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.