题目内容
3.铜既能与稀硝酸反应,也能与浓硝酸反应,当硝酸浓度不确定时,反应的产物也会有所不同,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平).按要求回答下列问题:(1)硝酸在反应中的作用是氧化剂(填“氧化剂”或“还原剂”),该反应的还原产物是NO、NO2;
(2)若反应中用浓硝酸,请写出发生反应的化学方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(3)若反应得到的NO和NO2物质的量相同,请写出发生的反应方程式并配平:2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O;
(4)在(3)的反应中,若有0.3mol Cu被硝酸完全溶解,那么参加反应的硝酸的物质的量是0.9mol,
(5)若用排水法收集在(3)的反应中产生的气体,收集到的气体是NO,标准状况下该气体的体积是4.48L.
分析 (1)该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,据此判断硝酸性质;
(2)若反应中用浓硝酸,应生成二氧化氮和水;
(3)若反应得到的NO和NO2物质的量相同,N元素化合价由+5价分别降低为+2价、+4价,共降低4价,Cu元素化合价由0价升高为+2价,升高2价,结合电子守恒、质量守恒配平;
(4)根据(3)所得方程式计算;
(5)二氧化氮和水反应生成NO,结合方程式计算生成气体的体积.
解答 解:(1)该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,所以硝酸体现氧化性和酸性,为氧化剂,该反应的还原产物是NO、NO2,
故答案为:氧化剂;NO、NO2;
(2)若反应中用浓硝酸,应生成二氧化氮和水,发生Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(3)若反应得到的NO和NO2物质的量相同,N元素化合价由+5价分别降低为+2价、+4价,共降低4价,Cu元素化合价由0价升高为+2价,升高2价,则反应的方程式中应满足2n(Cu)=n(NO)+n(NO2),方程式为2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O,
故答案为:2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O;
(4)方程式为2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O,由方程式可知若有0.3mol Cu被硝酸完全溶解,那么参加反应的硝酸的物质的量是0.9mol,
故答案为:0.9mol;
(5)在(3)的反应中产生的气体有NO和NO2,用排水法收集发生3NO2+H2O=2HNO3+NO,则收集到NO气体,0.3molCu发生2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O,可知生成0.15molNO、0.15molNO2,发生3NO2+H2O=2HNO3+NO,则用排水法收集后得到0.15mol+0.05mol=0.2molNO气体,标准状况下该气体的体积是0.2mol×22.4L/mol=4.48L,
故答案为:NO;4.48L.
点评 本题涉及氧化还原反应计算、化学方程式的配平等知识点,为高频考点,侧重考查学生的分析、计算能力,题目较综合,把握题干中信息及发生的化学反应是解本题关键,题目难度较大.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 单质的熔沸点随着原子序数的增加而升高 | |
| D. | 碱金属单质与水剧烈反应生成碱和氢气 |
| A. | 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 暖冰中水分子的各原子均满足8电子稳定结构 | |
| C. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| 混合物 | 除杂质的试剂 | 除杂质的方法 |
| 苯(苯酚) | NaOH溶液 | 分液 |
| 酒精(水) | 生石灰 | 蒸馏 |
| 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |

| A. | 4 | B. | 6 | C. | 8 | D. | 12 |
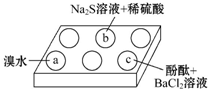
(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2L.
| A. | 沸点:PH3<NH3<H2O | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 酸性:H2CO3<HClO<HNO3 |
| A. | 电子总是先排布在能量最低的电子层里 | |
| B. | 每个电子层最多能容纳的电子数为2n2 | |
| C. | 最外层电子数不超过8个(K为最外层时不超过2个) | |
| D. | S2-的M层电子数是K层电子数的3倍 |