题目内容
13.下列对碱金属性质的叙述中,正确的是( )| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 单质的熔沸点随着原子序数的增加而升高 | |
| D. | 碱金属单质与水剧烈反应生成碱和氢气 |
分析 A.铯是金黄色的金属;
B.锂在空气中燃烧生成氧化锂;
C.金属晶体中金属原子的半径越大,金属键越弱,晶体的熔沸点越低;
D.碱金属单质,性质活泼,与水剧烈反应生成碱和氢气;
解答 解:A.铯是金黄色,不是银白色,故A错误;
B.锂在空气中燃烧生成氧化锂,故B错误;
C.碱金属都是金属晶体,碱金属从上到下原子半径依次增大,金属键依次减弱,单质的熔沸点依次降低,故C错误;
D.碱金属单质,性质活泼,与水剧烈反应生成碱和氢气,故D正确;
故选D.
点评 本题考查了碱金属的性质,本题考查了,注意抓住碱金属性质递变规律分析判断,掌握基础是关键,题目比较简单.

练习册系列答案
相关题目
16.氢能是高效清洁的合体能源,也是一种极具发展潜力的清洁能源.

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示:
①反应Ⅰ的离子方程式是SO2+2H2O+I2=SO42-+2I-+4H+,反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层.经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mo1-1
它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mo1-1;
ⅱ.SO3(g)分解写出SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
(2)工业上利用吸热反应C(s)+2H2O(g)═CO2(g)+2H2(g),也可制备氢气.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
①T1℃时,该反应的平衡常数K=12.8.T1>T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量的浓度B(填选项字母).
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
③某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图2所示.可见在t1、t3、t5、t7时反应都达到了平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,t4时刻改变的条件是降低温度.
(3)如图3是一种电化学制备H2的方法,装置中的MEA为允许质子通过的电解质膜.
①写出阳极电极的反应式:CH3OH+H2O-6e-=CO2↑+6H+.
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示:
①反应Ⅰ的离子方程式是SO2+2H2O+I2=SO42-+2I-+4H+,反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层.经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mo1-1
它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mo1-1;
ⅱ.SO3(g)分解写出SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
(2)工业上利用吸热反应C(s)+2H2O(g)═CO2(g)+2H2(g),也可制备氢气.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
| C(s) | H2O(g) | H2(g) | |||
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量的浓度B(填选项字母).
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
③某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图2所示.可见在t1、t3、t5、t7时反应都达到了平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,t4时刻改变的条件是降低温度.
(3)如图3是一种电化学制备H2的方法,装置中的MEA为允许质子通过的电解质膜.
①写出阳极电极的反应式:CH3OH+H2O-6e-=CO2↑+6H+.
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.
1.在一定的温度下,在固定容积的密闭容器中,能表示反应X(气)+2Y(气)?2Z(气)一定达到化学平衡状态的是( )
①容器内压强不随时间改变; ②C(x)•C2(Y)=C2(z);③生成Z的速率与生成Y的速率相等; ④容器内混合气体的密度不随时间改变;⑤X、Y、Z的物质的量之比 1:2:2.
①容器内压强不随时间改变; ②C(x)•C2(Y)=C2(z);③生成Z的速率与生成Y的速率相等; ④容器内混合气体的密度不随时间改变;⑤X、Y、Z的物质的量之比 1:2:2.
| A. | ①③⑤ | B. | ①③ | C. | ②④ | D. | 全部 |
5.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| A. | 己烷(己烯) 溴水 分液 | B. | 淀粉溶液(NaCl) 水 过滤 | ||
| C. | CH3CH2OH(CH3COOH) CaO 蒸馏 | D. | CO2(SO2) Na2CO3溶液 洗气 |
2.某气态烃0.5mol能和1mol HCl充分加成,加成产物1mol又能和6mol Cl2完全取代,则该烃是( )
| A. | C2H6 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
 .
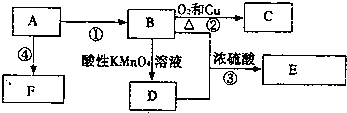
.

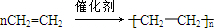 ,反应类型加聚反应.
,反应类型加聚反应.