题目内容
15.下列排序正确的是( )| A. | 沸点:PH3<NH3<H2O | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 酸性:H2CO3<HClO<HNO3 |
分析 A.含氢键的沸点高,水中氢键数目多;
B.金属性越强,对应最高价氧化物的水化物碱性越强;
C.熔点一般为原子晶体>离子晶体>分子晶体;
D.非金属性越强,对应最高价氧化物的水化物酸性越强.
解答 解:A.氨气、水分子间均含氢键,水中氢键数目多,则沸点:PH3<NH3<H2O,故A正确;
B.金属性K>Ca,Ba>Ca,对应最高价氧化物的水化物碱性为Ba(OH)2>Ca(OH)2,故B错误;
C.熔点一般为原子晶体>离子晶体>分子晶体,则熔点:SiCl4(分子晶体)<MgBr2(离子晶体)<BN(原子晶体),故C错误;
D.非金属性N>C,对应最高价氧化物的水化物酸性为H2CO3<HNO3,且碳酸与NaClO反应生成HClO,则酸性为H2CO3>HClO,故D错误;
故选A.
点评 本题考查周期表和周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
5.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| A. | 己烷(己烯) 溴水 分液 | B. | 淀粉溶液(NaCl) 水 过滤 | ||
| C. | CH3CH2OH(CH3COOH) CaO 蒸馏 | D. | CO2(SO2) Na2CO3溶液 洗气 |
6.下列粒子半径之比大于1的是( )
| A. | r(Al)/r(Na) | B. | r(C)/r(Si) | C. | r(F?)/r(Mg2+) | D. | r(Fe2+)/r(Fe) |
7.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料.下列实验事实与硝酸性质不相对应的一组是( )
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
5.下列说法正确的是( )
| A. | 化合反应均是放热反应 | B. | 中和反应都是放热反应 | ||
| C. | 吸热反应只吸收外界能量 | D. | 氧化还原反应均是放热反应 |
 ,请回答下列问题.
,请回答下列问题. .
. 3,3,4-三甲基己烷
3,3,4-三甲基己烷 2,2,3-三甲基戊烷
2,2,3-三甲基戊烷 2-甲基-2,4-己二烯
2-甲基-2,4-己二烯 2,3-二乙基-1-己烯.
2,3-二乙基-1-己烯.
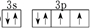
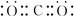
 ,该电子排布图错误的理由是违背了洪特规则.
,该电子排布图错误的理由是违背了洪特规则.