题目内容
18.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+转化为氢氧化铁沉淀而除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成碱式碳酸铜产量减少的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示图,现由硫酸锰溶液制备MnSO4•H2O的实验方案为蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥.

(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或者部分晶体失去结晶水(任写一种).
分析 辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,都含少量Fe2O3、SiO2等杂质,加入稀硫酸浸取,过滤得到SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,用氨水调节溶液pH使铁离子转化为氢氧化铁过滤除去,不会引入新杂质,滤液中加入碳酸氢铵和氨水,使锰离子转化为碳酸锰,碳酸锰再与硫酸反应,经过蒸发结晶得到硫酸锰晶体.过滤得到滤液赶出的氨气可以循环使用,同时得到碱式碳酸铜.
(1)矿石颗粒大小影响反应速率,温度升高反应加快,搅拌也可以提高浸取率;
(2)调节溶液pH目的是除去Fe3+离子,Cu2+、Mn2+不能沉淀;
(3)氨气可以循环利用;
(4)温度过高,碱式碳酸铜为分解,温度过低,会有较多的[Cu(NH3)4]SO4存在;
(5)低于40℃结晶析出MnSO4.5H2O,高于40℃结晶析出MnSO4.H2O,趁热过滤,用酒精洗涤,减少溶解损失,在低温下干燥,防止失去结晶水;
(6)可能洗涤不干净,混有硫酸盐,或者部分晶体失去结晶水等.
解答 解:辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,都含少量Fe2O3、SiO2等杂质,加入稀硫酸浸取,过滤得到SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,用氨水调节溶液pH使铁离子转化为氢氧化铁过滤除去,不会引入新杂质,滤液中加入碳酸氢铵和氨水,使锰离子转化为碳酸锰,碳酸锰再与硫酸反应,经过蒸发结晶得到硫酸锰晶体.过滤得到滤液赶出的氨气可以循环使用,同时得到碱式碳酸铜.
(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
故答案为:粉碎矿石、升高温度(或适当增加酸的浓度或搅拌);
(2)调节溶液pH目的是使Fe3+转化为氢氧化铁沉淀而除去,Cu2+、Mn2+不能沉淀,可以用氨水,不会引入新杂质,要除去滤液中的Fe3+离子,溶液pH=3.2使Fe3+离子完全沉淀,溶液pH=4.4时铜离子开始沉淀,故pH范围是3.2≤pH<4.4,
故答案为:3.2≤PH<4.4;使Fe3+转化为氢氧化铁沉淀而除去;
(3)由上述分析可知,NH3可以循环利用,
故答案为:NH3;
(4)温度过高,碱式碳酸铜为分解,温度过低,会有较多的[Cu(NH3)4]SO4存在,都将造成碱式碳酸铜产量减少,
故答案为:碱式碳酸铜产量减少;
(5)低于40℃结晶析出MnSO4.5H2O,高于40℃结晶析出MnSO4.H2O,由硫酸锰溶液制备MnSO4•H2O的实验方案为:蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥,
故答案为:蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥;
(6)可能洗涤不干净,混有硫酸盐杂质,或者部分晶体失去结晶水等,导致样品纯度大于100%,
故答案为:混有硫酸盐杂质或者部分晶体失去结晶水.
点评 本题属于化学工艺流程题目,以物质制备为载体,考查物质分离提纯、实验条件控制、信息提取与迁移运用,关键是理解工艺流程,较好的考查学生分析能力、化学实验能力,难度中等.

下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
由表中数据能否得出这样的结论:
(1)半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)
(2)非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;
(3)试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
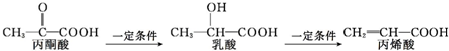
下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
| A. | 硅酸钠溶液 | B. | 氢氟酸 | C. | 蔗糖溶液 | D. | 氯化钠溶液 |
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的总反应式可表述为Zn+2NH4++2MnO2═Zn2++2NH3+2MnO(OH).则对应的正极反应式应为MnO2+e-+NH4+=MnO(OH)+NH3,MnO(OH)中锰元素的化合价为+3价.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,若将滤液加热蒸发,首先应该析出的物质应是NH4Cl,原因是同温下它的溶解度远小于ZnCl2;滤渣的主要成分是MnO2、MnO(OH)和碳粉.
(3)废电池的锌皮中有少量杂质铁、将其加入稀硫酸溶解,再加入双氧水,加碱调节pH可得到Fe(OH)3沉淀.加入双氧水时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;铁离子开始沉淀时的溶液的pH应为(假定Fe3+为0.01mol•L-1)2;若上述过程不加双氧水就加碱调节pH,直接得到的沉淀中应主要含有Zn(OH)2和Fe(OH)2.
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
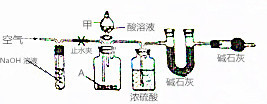 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下: