题目内容
6.下列叙述错误的是( )| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到平衡状态时,正、逆反应速率相等 | |
| C. | 化学反应达到平衡状态与时间的长短无关 | |
| D. | 化学平衡状态是不可改变的 |
分析 A、可逆反应不可能完全反应,存在反应限度;
B.反应达到限度时,正逆反应速率相等;
C.化学反应的限度只与反应物的性质、温度、浓度和压强有关,与反应的时间长短无关;
D.当外界条件变化时,化学反应的限度可发生变化.
解答 解:A、可逆反应中,当正逆反应相等时,达到反应限度,可逆反应不可能完全反应,存在反应限度,故A正确;
B.化学反应达到限度时,正逆反应速率相等,但不是0,故B正确;
C.化学反应的限度只与反应物的性质、温度、浓度和压强有关,与反应的时间长短无关,故C正确;
D.当外界条件变化时,如正反应速率和逆反应速率不相等,则化学反应的限度可发生变化,故D错误;
故选D.
点评 本题考查化学反应的限度与可逆反应,题目难度不大,注意理解可逆反应的特征和化学反应的限度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.如图为反应H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法不正确的是( )
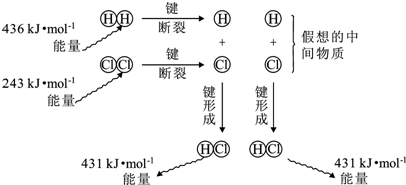

| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
17.2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)是制备硫酸的重要反应.下列叙述中,正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
14.几种短周期元素的原子半径及主要化合价见下表:下列叙述不正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、M的单质在相同条件下与相同浓度稀盐酸反应的反应速率为L>M | |
| B. | M与T形成的化合物有两性 | |
| C. | Q是硫元素 | |
| D. | L、Q形成的简单离子核外电子数相等 |
11.写出下列基团的名称:
 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH |
15.某烃含碳元素的质量分数为85.7%,则该烃是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 不能确定 |
16.除去CO2中混有的少量SO2气体,不可选用的试剂是( )
| A. | KMnO4溶液 | B. | NaClO溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和Na2CO3溶液 |