题目内容
14.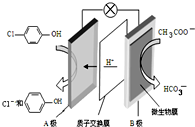 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A为电池的正极,发生还原反应 | |
| C. | A极的电极反应式为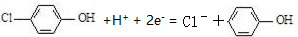 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,以此解答该题.
-OH+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极.
-OH+Cl-,电流从正极经导线流向负极.
A.电流从正极A沿导线流向负极B,故A错误;
B.A为正极,发生还原反应,故B正确;
C.A为正极,正极有氢离子参与反应,电极反应式为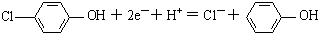 ,故C正确;
,故C正确;
D.据电荷守恒,当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA,故D正确;
故选:A.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中.

练习册系列答案
相关题目
2.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得,下列有关说法正确的是( )
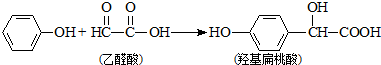
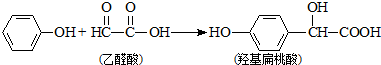
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
9.下列现象或事实可用同一原理解释的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
19.工业上以锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂.其部分工业流程如图:
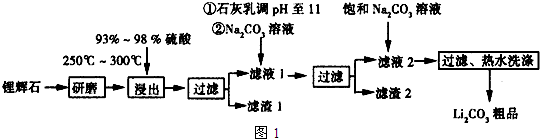
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
(1)从滤渣1中分离出Al2O3部分的流程如图2所示,括号表示加入的试剂,方框表示所得的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+
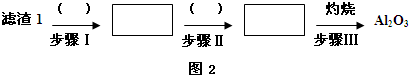
请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.
6.下列哪种物质可以鉴别乙醇和乙醛( )
| A. | 新制氢氧化铜 | B. | 碳酸钠溶液 | C. | 高锰酸钾溶液 | D. | FeCl3溶液 |
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA | |
| B. | 常温常压下,11.2 L CO2中含有的分子数是0.5NA | |
| C. | 标准状况下,22.4 L水所含原子数为3NA | |
| D. | 常温常压下,48 g O3和O2的混合气体中氧原子数为3NA |
10.下列电子式书写正确的是( )
| A. | 氯化钠  | B. | 氨气  | C. | NH4Cl的电子式 | D. | 硫化钠 |

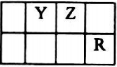 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: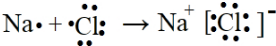 .
.