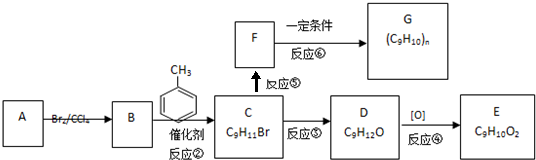
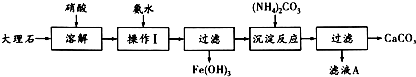
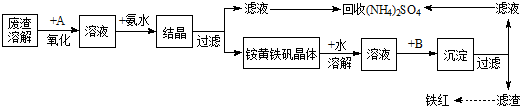
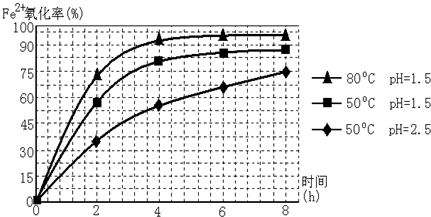
题目内容
4.6g Na在空气中完全被氧化,生成的白色物质溶于一定量的水中,得到200mL溶液,计算:
(1)白色物质的质量;
(2)所得溶液的物质的量浓度.
(1)白色物质的质量;
(2)所得溶液的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:(1)Na为活泼金属,在空气中易被氧气氧化生成氧化钠,4.6g Na在空气中完全被氧化,全部转化为氧化钠根据氧化方程式计算;
(2)白色物质为氧化钠,溶于水中和水反应生成氢氧化钠,根据反应的方程式计算生成的氢氧化钠的物质的量,根据c=
计算所得溶液的物质的量浓度.
(2)白色物质为氧化钠,溶于水中和水反应生成氢氧化钠,根据反应的方程式计算生成的氢氧化钠的物质的量,根据c=
| n |
| v |
解答:
解:(1)Na为活泼金属,在空气中易被氧气氧化生成氧化钠,
4Na+O2 =2Na2O
4mol 2mol
n(Na2O)
n(Na2O)=0.1mol,m(Na2O)=n×M=0.1mol×62g/mol=6.2g,
答:白色物质为Na2O,质量为6.2g;
(2)白色物质为氧化钠,溶于水中和水反应生成氢氧化钠,
2Na2O+2H2O=4NaOH
4mol 4mol
0.1mol n(NaOH) n(NaOH)=0.2mol,
氢氧化钠的物质的量浓度为:c=
=
=1mol/L,
答:所得氢氧化钠溶液的物质的量浓度为1mol/L.
4Na+O2 =2Na2O
4mol 2mol
| 4.6g |
| 23g/mol |
n(Na2O)=0.1mol,m(Na2O)=n×M=0.1mol×62g/mol=6.2g,
答:白色物质为Na2O,质量为6.2g;
(2)白色物质为氧化钠,溶于水中和水反应生成氢氧化钠,
2Na2O+2H2O=4NaOH
4mol 4mol
0.1mol n(NaOH) n(NaOH)=0.2mol,
氢氧化钠的物质的量浓度为:c=
| n |
| v |
| 0.2mol |
| 0.2L |
答:所得氢氧化钠溶液的物质的量浓度为1mol/L.
点评:本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意钠在空气中被氧化成氧化钠为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于0.05mol?L-1的K2SO4溶液的说法中,正确的是( )
| A、1L溶液中含有K+数目是0.1NA |
| B、1L溶液中含有K+、SO42-总数为0.1NA |
| C、1 L溶液中K+的浓度是0.05 mol?L-1 |
| D、2 L溶液中含有SO42-的浓度是0.1mol?L-1 |
下列说法正确的是( )
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、对于△H<0,△S>0的反应,不仅能自发进行,反应速率也很快 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |