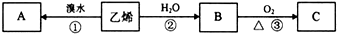
题目内容
某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
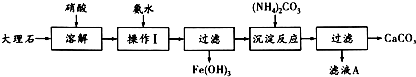
(1)溶解大理石时,用硝酸而不用硫酸的原理是: .
(2)操作Ⅰ的目的是: ,该反应的离子方程式是: .
(3)写出检验滤液中是否含有Fe3+的方法: .
(4)写出加入(NH4)2CO3所发生反应的离子方程式: ,滤液A的一种用途是 .

(1)溶解大理石时,用硝酸而不用硫酸的原理是:
(2)操作Ⅰ的目的是:
(3)写出检验滤液中是否含有Fe3+的方法:
(4)写出加入(NH4)2CO3所发生反应的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:碳酸钙和氧化铁的混合物中加入硝酸将之溶解,得到硝酸钙以及硝酸铁的混合溶液,向其中加入氨水,调节pH可以得到氢氧化铁沉淀,过滤,得到的滤液中加入碳酸铵,可以得到碳酸钙以及硝酸铵,硝酸铵是一种化学肥料.
(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水;
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加氨水的方法调节pH,将铁离子沉淀;
(3)三价铁离子遇到硫氰酸根离子会呈现红色,据此检验铁离子;
(4)碳酸根离子和钙离子反应生成碳酸钙沉淀;滤液A的溶质是NH4NO3,可以用作化肥.
(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水;
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加氨水的方法调节pH,将铁离子沉淀;
(3)三价铁离子遇到硫氰酸根离子会呈现红色,据此检验铁离子;
(4)碳酸根离子和钙离子反应生成碳酸钙沉淀;滤液A的溶质是NH4NO3,可以用作化肥.
解答:
解:碳酸钙和氧化铁的混合物中加入硝酸将之溶解,得到硝酸钙以及硝酸铁的混合溶液,向其中加入氨水,调节pH可以得到氢氧化铁沉淀,过滤,得到的滤液中加入碳酸铵,可以得到碳酸钙以及硝酸铵,硝酸铵是一种化学肥料.
(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生,
故答案为:硫酸钙微溶于水;
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,当溶质只能是共价化合物时为氨水,发生的反应为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;故答案为:除去溶液中的Fe3+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)三价铁离子遇到硫氰酸根离子会呈现红色,Fe3++3SCN-?Fe(SCN)3溶液,取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+;
(4)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,滤液B的溶质是NH4NO3,可以用作化肥,
故答案为:Ca2++CO32-=CaCO3↓;作化肥.
(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生,
故答案为:硫酸钙微溶于水;
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,当溶质只能是共价化合物时为氨水,发生的反应为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;故答案为:除去溶液中的Fe3+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)三价铁离子遇到硫氰酸根离子会呈现红色,Fe3++3SCN-?Fe(SCN)3溶液,取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+;
(4)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,滤液B的溶质是NH4NO3,可以用作化肥,
故答案为:Ca2++CO32-=CaCO3↓;作化肥.
点评:本题考查了大理石的提纯,涉及实验方法和实验操作等问题,做题时注意分析题目中的关键信息,本题难度中等.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
下列说法中正确的是( )
| A、金属阳离子一定只具有氧化性 |
| B、金属单质作反应物时一定不是氧化剂 |
| C、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| D、氧化还原反应中的反应物,不是氧化剂就是还原剂 |
下列叙述不正确的是( )
| A、由130 56Ba 可推断其原子核外电子排布及元素的相对原子质量 |
| B、通过化学变化无法实现16O2与18O2间的相互转化 |
| C、Ca(HCO3)2、Fe(OH)3、FeCl2均可通过化合反应制得 |
| D、等物质的量KMnO4和MnO2分别与足量的浓盐酸反应,前者生成氯气体积大(标况) |